Introducción
El cuadro clínico de Influenza A (H1N1) pandémica es bastante uniforme en todos los países. La gran mayoría de las personas que adquieren el nuevo virus de Influenza A (H1N1) enferman con formas benignas catarrales, con una recuperación relativamente rápida y otras, inclusive, no presentan prácticamente síntomas. 1 Sin embargo, el virus es capaz de provocar una enfermedad grave que puede requerir el ingreso en cuidados intensivos y llevar al paciente a la muerte —sobre todo a consecuencia de una neumonía complicada, viral primaria o mixta con una infección bacteriana sobreañadida, así como un síndrome de distress respiratorio del adulto asociado—, aunque las cifras de tales casos se mantienen relativamente bajas. Una de las características principales de la pandemia actual es la presencia de nuevos grupos de alto riesgo para desarrollar dichas complicaciones. 2
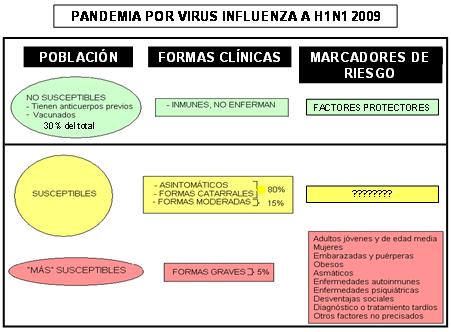
Las formas clínicas graves y la mortalidad en esta pandemia han ocurrido, en su mayoría, en niños, adolescentes y adultos, entre las edades de 10 y 60 años, aparentemente saludables, y no en los adultos mayores ni en personas con enfermedades debilitantes, como es lo habitual en la Influenza estacional. Se ha observado una mayor tendencia a desarrollar una Influenza grave en las mujeres, con las embarazadas y las puérperas como grupos especiales de alto riesgo. 3-5 Ha llamado también la atención, por su mayor frecuencia entre los pacientes extremamente enfermos, la obesidad y el antecedente de asma bronquial, 6, 7 aunque no se ha evidenciado una comorbilidad médica específica en el 40 a 50% de los casos fatales. 8-10 Este es el panorama, en la "primera ola" de la epidemia. Pero la respuesta a la pregunta, por qué estos grupos de riesgo padecen de formas graves de la enfermedad, todavía no tiene una clara respuesta para muchos.
El propósito de tratar de responder a esa interrogante no sólo tiene aspectos teóricos, sino prácticos, como contribución a la prevención y al control de dichos casos, pues para llevar a cabo intervenciones apropiadas, tanto de salud pública como clínicas, es importante reconocer no sólo a aquéllos que tienen más posibilidad de enfermar, sino también a los que tienen alto riesgo para presentar complicaciones graves y una mala evolución.
Las enfermedades no se distribuyen al azar en la población. 11 La presentación clínica y el pronóstico de las enfermedades infecciosas dependen, fundamentalmente, de la virulencia del agente patógeno y/o de la predisposición individual —genética o adquirida— de cada persona a padecer determinado tipo de infección. 12, 13, 14 Otros factores, relacionados con la atención médica, como el retraso en el diagnóstico o en el tratamiento precoz con antivirales, también pudieran explicar la mala evolución de un grupo de casos. 15, 16
Llegados a este punto, nos preguntamos: ¿Son las características del nuevo virus, o la carga viral del mismo, determinantes cruciales de la peor evolución de los que llegan a convertirse en pacientes críticos? ¿Es una respuesta inmune anormal de los afectados, la causa de estos casos graves y de las muertes que ocurren? ¿Dependen las complicaciones graves de las demoras en el diagnóstico y/o en el inicio del tratamiento antiviral específico?
El virus. El agente universal, la causa necesaria
La causa necesaria es aquella en cuya ausencia la enfermedad no puede desarrollarse. Es la que realmente determina la incidencia. Si se erradica, la enfermedad seguro nunca puede aparecer.17 En el caso de las enfermedades transmisibles se identifica con el agente infeccioso causal. En la tuberculosis, el bacilo de Koch; en la fiebre tifoidea, la Salmonella Typhi; en la gripe, los virus de la Influenza
La cepa actual es genéticamente diferente al subtipo H1N1 de la influenza estacional completamente humana que ha estado circulando mundialmente en los últimos años, aunque se ha referido que alrededor de un 30% de algunas poblaciones —especialmente en los grupos de edad mayores de 40 años— tienen anticuerpos “protectores”, por exposiciones previas a un virus de similar antigenicidad, pues se recoge el antecedente de una epidemia por virus de Influenza A (H1N1) en 1975, o por vacunación previa contra otros virus de Influenza. 18 La nueva cepa S-OIV contiene ADN (ácido desoxirribonucleico) típico del virus de las aves, cerdos y humanos, incluyendo elementos de virus de cerdos de Europa y Asia. 19
En la búsqueda de una explicación plausible a estas interrogantes, revisamos la literatura disponible relacionada con las posibles causas de la elevada letalidad en epidemias anteriores de Influenza. Siempre sospechamos que era obligado indagar entre los trabajos relacionados con la pandemia de Influenza A (H1N1), también conocida como Gripe española, que azotó al mundo en 1918 y que produjo un aproximado de 50 millones de muertes, en una población entonces relativamente joven.20-23 Varios elementos justificaban esa pesquisa: a) el carácter de pandemia, no sólo de epidemia; b) el tratarse de un virus similar de Influenza A (H1N1); y c) el hecho de que los casos más graves, en 1918, también se informaron en adultos jóvenes, saludables e inmunocompetentes. 24-26
Así las cosas, encontramos que Kobasa, et al., 20 en 2007, estudiando la virulencia del agente de Influenza A (H1N1) de 1918 y su transmisión a monos macacos, evidenciaron una respuesta inmune anormal en ellos, caracterizada por una desregulación de la respuesta inmune innata antiviral, que fue insuficiente para protegerlos. De aquí que éstos y otros investigadores21 dedujeron que una respuesta inmune innata del huésped atípica, debido a la habilidad de ese tipo de virus de la Influenza de modular la misma y ocasionar una desregulación de la respuesta antiviral, —desencadenando lo que hoy conocemos como una verdadera “tormenta de citoquinas”—, pudo contribuir a una mayor letalidad, en la epidemia de 1918.27
Se ha informado que el nuevo virus H1N1 de la pandemia actual, ocasiona lesiones patológicas más graves en los pulmones de ratones, hurones y primates infectados, que las producidas por el virus H1N1 hasta ahora conocido en casos de influenza estacional humana. 28
Entre los factores que incrementa la virulencia del virus de la Influenza A, ha estado implicada la proteína PB1-F2, pero el mecanismo exacto por el cual ella incrementa la patogenicidad viral no está bien comprendido. Su relación con la presentación de los casos graves de Influenza A (H1N1), se ha atribuido a la disrupción de la expresión de la proteína PB1-F2. 29 Sin embargo, no se ha encontrado aumento de la carga viral en los pulmones de ratones expuestos a los virus H1N1 de la pandemia de 1918 y de 1956. 30 Si la proteína PB1-F2 no altera la carga viral en los ratones, ¿cómo contribuye entonces a incrementar la virulencia en los ratones o en los humanos? Una posibilidad es que su habilidad para causar muerte celular contribuya a la mayor virulencia, causando daño de las células epiteliales o matando células efectoras inmunes. 31
Lo cierto es que cualquier lesión a los tejidos, como la producida por la invasión y multiplicación de microorganismos, desencadena siempre una respuesta inflamatoria. 27 La respuesta inmune innata de los macrófagos —nuestra primera línea de defensa esencial para limitar las enfermedades ocasionadas por virus—, incluye la liberación de citoquinas, como la interleukina I (IL-I) y el factor-α de necrosis tumoral (TNF-α). Los otros mediadores liberados a partir de los macrófagos activados, incluyen las prostaglandinas y los leukotrienos. Estos mediadores proinflamatorios comienzan a producir cambios en los vasos sanguíneos locales, que se inician con la dilatación de arteriolas y capilares, a través de los cuales escapa el plasma. El líquido del edema se acumula en el área afectada y la fibrina forma una malla que ocluye los canales linfáticos, limitando la diseminación de los microorganismos. Un segundo efecto de los mediadores es inducir cambios en la expresión de varias moléculas de adhesión en las células endoteliales y en los leucocitos. Las moléculas de adhesión, como las selectinas y las integrinas, producen la adhesión de los leucocitos a las células endoteliales de los vasos sanguíneos y de este modo promueven su movimiento a través de la pared vascular. Así, los leucocitos polimorfonucleares en los capilares se adhieren fuertemente a sus paredes y migran (extravasación) de los capilares en dirección al irritante. La migración (quimiomotaxis) es estimulada mediante sustancias presentes en el exudado inflamatorio, incluyendo algunos pequeños péptidos llamados quimioquinas. Las quimioquinas son sintetizadas por los macrófagos y las células endoteliales. La IL-8 es un ejemplo de quimioquina. Estos compuestos funcionan principalmente reclutando monocitos y neutrófilos de la sangre a los sitios de infección. Los fagocitos engloban los microorganismos y comienza su digestión intracelular. Pronto el pH del área inflamada comienza a ser más ácido y las proteasas celulares inducen a la lisis de los leucocitos. Grandes macrófagos mononucleares arriban al sitio y, a su vez, engloban los detritus leucocíticos y los microorganismos y favorecen la resolución del proceso inflamatorio local. En esta etapa de la respuesta inmune, también se producen a y b interferones.
Dadas las semejanzas del nuevo virus de la Influenza A (H1N1) actual con el de 1918, es lógico plantear que una respuesta inmune innata desenfrenada o excesiva secundaria a una alta replicación viral, puede ser también dañina ahora y contribuir a la incrementar la virulencia del virus patogénico, causando una excesiva infiltración de los tejidos por células inmunológicas, lo que llevaría a la destrucción tisular. Pero, si fuera el caso de que estemos ante un “supervirus” ¿por qué no todos los que lo adquieren, enferman gravemente?
El huésped. La respuesta inmune individual, las causas suficientes
Las causas suficientes, son las que permiten el desarrollo de la enfermedad y modulan sus características. Generalmente, las causas suficientes no son un único factor, sino varios factores de riesgo. 32, 33, 34 Sin embargo, no se requiere identificar todos los componentes de las causas suficientes para que se pueda hacer una prevención efectiva. La eliminación de algunos de los componentes puede interferir con la acción de los otros y esto puede prevenir la enfermedad. El típico ejemplo, fue la brillante propuesta de Carlos J. Finlay, que al eliminar el mosquito Aedes aegypti (una causa suficiente de gran peso), aún sin conocer el agente viral causante (causa necesaria), se rompía la cadena de transmisión de la fiebre amarilla y, por tanto, se evitaba la enfermedad.
A la pregunta de cuáles eran las causas que habían provocado una epidemia de cólera en la India en los años 80 del siglo pasado, Milton Terris respondía más o menos así: “Entre las causas, estimo que están la desnutrición de las personas, la mala calidad del agua, la higiene deplorable, las tradiciones culturales, y así fue enumerando una serie de las que hoy se conocen como determinantes sociales de la salud en la población (causas suficientes en este caso), para al final decir… ah, y también la presencia de algunos vibriones coléricos (causa necesaria) que estaban por allí”.
Al tratar de buscar semejanzas entre las personas con alto riesgo de padecer formas graves de la epidemia actual de Influenza A (H1N1), identificamos que la mayoría de ellas —al menos las que han enfermado en la que se ha denominado “primera ola”— pertenecen a grupos de la población que pudiéramos denominar como "hiperinmunes" o que tienen mayor competencia inmunológica natural (los más jóvenes, las mujeres, los bien nutridos y algunos con antecedentes de enfermedades inmunológicas como el asma bronquial),16 muy diferentes —como ya se expresó— a los grupos de mayor riesgo de complicaciones durante las epidemias de Influenza estacional.
Investigaciones realizadas por grupos liderados por Cameron y Bermejo-Martin, ya habían identificado una respuesta inmune específica del huésped en infecciones virales moderadas y graves, caracterizada por la presencia de citoquinas y quimioquinas, producidas por los virus del Síndrome Respiratorio Agudo Severo (SARS), de influenza H5N1 y Sincitial Respiratorio. En dichos estudios, la respuesta inmune temprana del huésped se caracterizaba por niveles sistémicos de quimioquinas, como la CXCL10, indicativa de una respuesta antiviral innata. 35-38 De Jong, et al., también demostraron una “hipercitoquinemia” de citoquinas y quimioquinas específicas, asociada con infecciones fatales por virus humano H5N1. 39
Basados en todo lo anteriormente expuesto, y en nuestra propia experiencia clínica en la atención directa y seguimiento de estos pacientes, proponemos que, de manera semejante al virus de la Influenza A (H1N1) de 1918, el nuevo virus de Influenza A (H1N1) —sobre todo cuando el diagnóstico no es precoz y/o el tratamiento del antiviral es tardío—, provoca una exagerada respuesta inmune innata, desenfrenada o excesiva, que contribuye a incrementar la virulencia del agente patógeno, causando una gran infiltración de los tejidos por células inmunológicas, lo que puede conllevar en estadios finales hasta la destrucción tisular. 15, 23 Pero, esta respuesta inmune innata aberrante y potencialmente mortal, se produce, de manera preferente, en las personas “hiperinmunes”. 16
Para determinar si la respuesta inmune del huésped juega algún papel en la gravedad de la evolución de la enfermedad producida por el nuevo virus H1N1, recientemente un grupo conjunto de investigadores españoles y canadienses, llevaron a cabo un análisis de las quimioquinas sistémicas y los niveles de citoquinas en suero en diversos grupos de pacientes con síntomas precoces de la enfermedad. 40
Una de las observaciones más interesantes de este estudio fue el aumento dramático de mediadores que estimulan las respuestas Th-1 (IFN-γ, TNF-α, IL-15, IL-12p70) y Th-17 (IL-8, IL-9, IL-17, IL-6) en los casos graves. 40 La inmunidad adaptativa Th-1 es una respuesta importante contra los microorganismos intracelulares como los virus. 41 La inmunidad Th-17 participa en el aclaramiento de patógenos durante las reacciones de defensa del huésped, pero también está involucrada en la inflamación del tejido en varias enfermedades autoinmunes, alérgicas y el asma. 42-46
Bermejo-Martín, et al., encontraron que, aunque la infección con el nuevo virus H1N1 induce una típica respuesta inmune innata, tanto en los pacientes con formas clínicas moderadas como graves, en los enfermos críticos con afectación respiratoria, se constató una secreción temprana de citoquinas Th17 y Th1, habitualmente asociadas con la inmunidad mediada por células, pero también ligadas comúnmente a la patogenia de enfermedades autoinmunes/inflamatorias. Concluyen que el papel exacto de los mediadores Th1 y Th17 en la evolución de los casos moderados y graves de la pandemia de Influenza A (H1N1), merece de nuevas investigaciones para aclarar el papel deletéreo o beneficioso de esas citoquinas en la gravedad de la enfermedad. 40
Como en el mencionado estudio se comprobaron niveles muy elevados de interleukina 17 (IL-17) en la sangre de pacientes con formas severas de la enfermedad y bajos niveles en los pacientes con formas moderadas, algunos han planteado que, de poder contar con esta determinación diagnóstica como un marcador de respuesta temprana del huésped en la Influenza pandémica severa, se podría conocer de manera precoz y rápida, quiénes están en riesgo de desarrollar la forma severa de la enfermedad.40 Claro, lo que no se puede asegurar es si la elevación de la IL-17 encontrada en casos graves es ocasionada por la virulencia del nuevo virus patógeno, o es una respuesta exagerada de un huésped predispuesto.
Por tanto, el planteamiento de que el compromiso pulmonar fatal resulta de una desregulación de la respuesta inmune del huésped, comúnmente referida como tormenta de citoquinas o hipercitoquinemia, se apoya en un extenso cuerpo de conocimientos de evidencias in vitro e in vivo, que muestran niveles muy elevados de mediadores proinflamatorios en el pulmón con neumonía grave en estos casos. 47
El ambiente. Factores sociales y servicios de salud. Más causas suficientes
De otras enfermedades infecciosas agudas hemos aprendido que si el diagnóstico se realiza tempranamente (primeros días de sintomatología, sobre todo antes del quinto día) y se impone el tratamiento adecuado de forma precoz (en particular en los casos que se conoce la eficacia de antimicrobianos que actúan específicamente contra determinados agentes patógenos), se evita o se reduce mucho la posibilidad de que se presenten formas clínicas graves de la enfermedad. En otras palabras, los casos críticos en enfermedades infecciosas agudas se presentan, generalmente, en pacientes con diagnóstico y tratamiento erróneos o tardíos, o cuando no se disponen o no se conocen tratamientos efectivos, donde influyen múltiples condiciones.
Estos pudieran ser también factores que ayudarían a explicar la aparición de formas graves en un grupo de enfermos —sin descartar que también sean más susceptibles a determinados agentes infecciosos—, en los que, por diversas causas —atribuibles a desventajas en su situación psico-socio-económico-cultural, o a fallos en los servicios de atención médica— se les hace un diagnóstico y/o un tratamiento, incorrectos o tardíos. Como elementos que pudieran apoyar estos planteamientos, están la inclusión de algunos casos con retraso mental, enfermedades psiquiátricas o condiciones de vida desfavorables, entre nuestros pacientes con formas graves y, posiblemente, la mayor proporción que la esperada de aborígenes australianos entre los enfermos críticos que han requerido cuidados intensivos en ese país y la alta mortalidad inicial reportada en México en poblaciones pobres. 15, 48
La observación clínica, siempre la clínica
A favor de los planteamientos realizados, tenemos ya algunos elementos (¿evidencias?), aparentemente aislados, que van surgiendo de la observación, basada en la experiencia clínica de nuestro grupo —los que algunos pudieran considerar todavía como “anecdóticos”—, pero todos obtenidos a partir de la asistencia de los pacientes con Enfermedad Tipo Influenza en el curso de esta epidemia, aunque algunos ya se comienzan a informar también por otros autores:*
• Enfermos con SIDA que adquieren la Influenza A (H1N1) y en los que la enfermedad ha transcurrido de manera benigna y autolimitada (algunos han referido que esto se debe a que están bajo tratamiento de antirretrovirales, pero esos medicamentos no tienen ningún efecto demostrado contra el virus de la Influenza) 49
• Presencia de cifras muy elevadas de marcadores séricos de inflamación aguda (proteína C reactiva) en los pacientes más graves 24
• Aparición de síndromes de patogenia inmunológica, extremadamente raros, en pacientes críticos (ejemplo, un caso de linfohistiocitosis hematofágica secundaria en el curso de una bronconeumonía grave con distress respiratorio del adulto)
• Algunos enfermos que han debutado con Leucemia linfoblástica aguda y grave bronconeumonía asociada, que han tenido una evolución rápidamente fatal
• Hallazgos histopatológicos en los fallecidos, con infiltración linfocítica tisular pulmonar
• Tratamiento antiviral tardío con Oseltamivir, en los enfermos que han presentado las formas más graves. 50
Comentario final
Resumiendo, aceptamos la multicausalidad de factores que intervienen en la aparición de las “nuevas” formas graves de Influenza A (H1N1) 2009, fundamentalmente la neumonía viral primaria potencialmente mortal, donde, además de características propias del nuevo virus (causa necesaria), se entremezclan otras variables (causas suficientes), entre las que se encuentran factores relacionados con una mayor susceptibilidad individual del huésped —ya sean genéticos o adquiridos, incluyendo factores psico-socio-económico-culturales— y con el proceso de atención médica, que ocasionan una desregulación de la respuesta inmune, aberrante, excesiva y potencialmente mortal, referida como tormenta de citoquinas, que se produce, de manera preferente, en personas “hiperinmunes”. En otras palabras, aunque es la infección viral la que acciona el gatillo, la susceptibilidad individual y el contexto son elementos obligados para cargar el arma.
El profesor Ilizástigui escribía que “la práctica existente es a veces insuficiente para establecer la veracidad de una teoría. Todo ello prueba la relatividad del criterio de la práctica, pero sólo los hechos, el desarrollo histórico, la actividad humana de hoy y de mañana es la forma más amplia con la cual se comprueba la teoría, o se sustituye por otra más consecuente con los hechos”. 51
Dado que se ha pronosticado que asistiremos a casos de Influenza A (H1N1) posiblemente hasta el 2011, basados en las consideraciones teóricas que se han expresado, se ratifica la necesidad de vigilar en la comunidad a los grupos identificados como de alto riesgo de padecer formas clínicas graves y en ellos insistir en el diagnóstico precoz y el tratamiento antiviral oportuno. Sin embargo, los servicios de asistencia médica tienen que estar preparados para enfrentar, al mismo tiempo, a todos, pues la mayor cantidad de la población se encuentra en los que pudiéramos considerar como grupos de bajo riesgo, pero allí también hay personas que pueden tener riesgos individuales muy variados –ya no como grupo- y ese es y será siempre el reto de la prevención y la atención clínica. Hoy no contamos con una prueba capaz de predecir qué paciente desarrollará una forma grave de la enfermedad y, por tanto, la identificación de cada caso que potencialmente puede desarrollar complicaciones graves, seguirá requiriendo de una elevada pericia clínica y de una vigilancia estrecha de su evolución. 24
Finalmente, de estas disquisiciones surgen también nuevas preguntas: Si la reducción de la carga "viral” de un agente potencialmente tan virulento es un problema fundamental en la terapia de pacientes que ya presentan las formas críticas, ¿cuál es el verdadero impacto de un tratamiento antiviral precoz en la prevención de las formas más graves de la enfermedad? ¿Sería necesaria la indicación, en los casos críticos, de una combinación de varias drogas antivirales sinérgicas, con mecanismos de acción diferentes, como las que se usan actualmente con éxito en otras infecciones virales severas, como el SIDA, más cuando ya se ha informado de la resistencia al Oseltamivir en varios reportes? 55-59
Si las complicaciones graves, cuando se presentan, se producen por una "tormenta de citoquinas" y el daño de los tejidos es causado por una respuesta inmune excesiva, ¿podría ser de utilidad alguna de las variantes de inmunoterapia en pacientes críticos seleccionados? 43, 60
¿Será la aplicación de la vacuna específica la solución definitiva para proteger a los grupos/individuos en riesgo de padecer de formas graves de la enfermedad? 58, 59 ¿Qué tan segura y eficaz resultará? 60 ¿Cuál será su aceptación por profesionales y público en general? 61
Nuevas respuestas originan nuevas interrogantes. Mientras tanto, todo el arsenal diagnóstico y terapéutico disponible para la atención de los enfermos críticos debe ponerse a disposición de los pacientes con complicaciones graves de la epidemia de Influenza actual que requieran asistencia y, especialmente, de cuidados intensivos. Al mismo tiempo, confiamos en que —al igual que ha sucedido en ocasiones previas—, a partir de esta situación de crisis sanitaria, seguramente surgirán nuevas soluciones y experiencias positivas para el enfrentamiento futuro de problemáticas similares.
-------------------------------------------------------------------
* Las situaciones clínicas que se mencionan aquí, se basan en la rica experiencia clínica adquirida en la asistencia médica directa a los pacientes, por los miembros del “Grupo Operativo Provincial de Atención Médica a los enfermos adultos hospitalizados en Cienfuegos”, del que hemos tenido la oportunidad ser integrantes y de participar de manera sistemática, desde su constitución.