CONCEPTO
La hemorragia subaracnoidea (HSA) es la extravasación de sangre en el espacio subaracnoideo y/o sus resultantes fisiopatológicas y clínicas. La hemorragia proviene de los vasos de la superficie del cerebro y se limita fundamentalmente al espacio subaracnoideo, pero en casos graves puede extenderse al parénquima o a los ventrículos cerebrales. Es un episodio clínico de aparición súbita, brusca, que constituye más un síndrome que una entidad nosológica, porque puede obedecer a diferentes causas.
ETIOLOGÍA
Clasificación etiológica de las HSA.
1. Malformaciones vasculares cerebrales (causa más frecuente: 70 % de las HSA). Enfermedad aneurismática: Aneurismas saculares de etiología congénito adquirida y estados preaneurismáticos (dilatación infundibuliforme del origen de la Arteria Comunicante Posterior) – 52- 60 % de todas las HSA; malformaciones arteriovenosas cerebrales (MAV) – 16 %, facomatosis.
2. Hemorragia cerebro-meníngea del. hipertenso – 15 %.
3. Traumatismo craneoencefálico.
4. Tumores cerebrales (primitivos y metastásicos).
5. Discrasias sanguíneas y coagulopatías.
6. Terapéutica anticoagulante insuficientemente controlada.
7. Meningitis y encefalitis.
8. Infecciones (Escarlatina, Fiebre tifoidea).
9. Enfermedades del colágeno (Arteritis encefálicas).
10. Intoxicaciones exógenas (Monóxido de Carbono) y endógenas (uremia).
11. HSA no precisadas (idiopáticas).
12. Otros tipos de aneurismas: micóticos (por agentes infecciosos, generalmente bacterias), fusiformes (por arterioesclerosis), traumáticos (verdaderos y falsos).
13. Lesiones espinales MAV y tumores medulares..
14. Golpe de calor.
15. SIDA.
16. Otros.
DIAGNÓSTICO
El diagnóstico incluye 3 etapas: sugestivo, positivo, etiológico; junto a cada etapa de diagnóstico se verá la conducta médica.
Cuadro clínico.
Se deben considerar 3 acápites: elementos prodrómicos o premonitorios; de estado y semiología asociada.
Elementos prodrómicos: Cefalea centinela (warning leak): Es el más importante síntoma premonitorio. Se presenta entre el 85- 97 % de los pacientes, en un período de días, semanas (generalmente 2), y hasta un mes previo a la HSA evidente. Es producida por la salida de poca cantidad de sangre al espacio subaracnoideo. Suele tener valor localizador. Puede concluir con la recuperación total del enfermo o terminar en un sangramiento mayor. Mareos, náuseas y vómitos. Déficit motor o sensorial transitorio. Diplopía. Trastornos visuales. Convulsiones.
Elementos de estado: Cefalea: (85- 95 % de los pacientes). Intensa, de inicio súbito y explosivo, desgarradora, en "casquete", no experimentada nunca antes de tal modo por el paciente. Muy intensa hasta el 5tº día. Rigidez nucal, signos meníngeos y fotofobia: Se hacen evidentes entre 4 y 6 horas después del sangramiento. Alteración variable de la conciencia (77 %): Puede ir desde una simple obnubilación hasta el coma profundo. Con más frecuencia la inconsciencia es transitoria. Encierra un gran valor pronóstico. Hipertensión arterial no controlada (50 %). Vómitos y náuseas (50 %). Defecto motor, sensitivo o del lenguaje. Defectos visuales campimétricos. Disfunción de nervios craneales (II, III, IV, V, VI, X, XI, XII pares). Crisis convulsivas. Al fondo de ojo: hemorragias subhialoideas, vítreas o retinianas (Síndrome de Terson). Otros (fiebre, panhipopituitarismo, disfagia, etc.).
Elementos semiológicos asociados: Hábito de fumar (69 % de los casos); obesidad y hábitos dietéticos inadecuados; enfermedad hipertensiva; asociación familiar: (6,7 %) describimos 3 tipos: HSA asociada con Síndromes hereditarios conocidos (Riñón poliquístico, Coartación de la Aorta, Ehlers- Danlos, Displasia fibromuscular); agregación familiar debido a factores de origen hereditario (hiperlipidemias, hipertensión arterial (HTA); Agregación familiar fortuita.
DIAGNÓSTICO
Primera etapa: Diagnóstico sugestivo o presuntivo. Se realiza en las áreas de salud, consultorios médicos de la familia, médico del centro de trabajo, policlínico provincial de urgencia (PPU), terapias intensivas municipales, cuerpo de guardia, etc. Se efectúa sobre la base del reconocimiento de los elementos premonitorios o de estado ya mencionados, sin comprobación por tomografía axial computarizada (TAC).
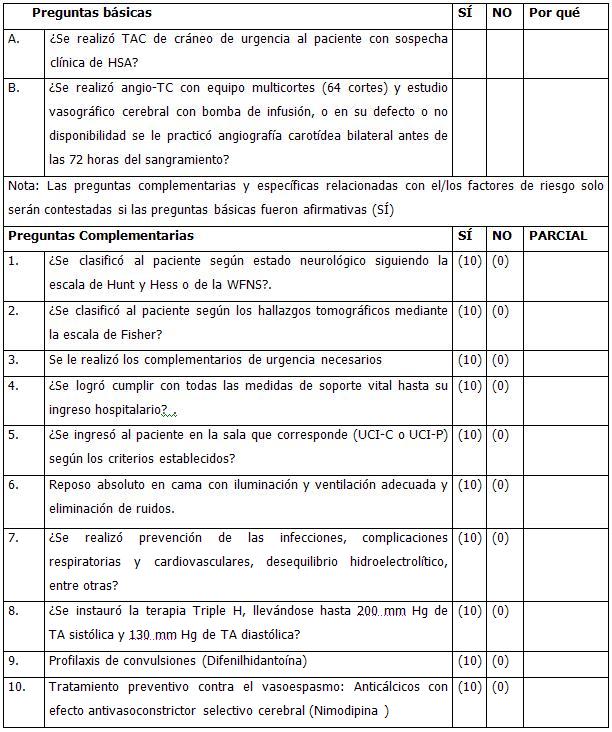
Segunda etapa: Diagnóstico positivo. Se realiza en el cuerpo de guardia del hospital. La confirmación diagnóstica está dada por la presencia de signos de sangramiento intracraneal, o sea, presencia de sangre en las cisternas subaracnoideas basales mediante TAC craneal (medio diagnóstico de elección). La confirmación del diagnóstico convierte de hecho a este paciente en un código rojo.
Clasificación de pacientes con HSA según resultados de la TAC (Fischer-Kistler-Davis, 1980):
• Grado I- No sangramiento detectado.
• Grado II- Deposición difusa de sangre en capas finas, con capas verticales (cisternas interhemisférica, ambiens o insulares) < 1 mm de espesor.
• Grado III- Coágulos localizados o capas verticales de sangre de > 1 mm de espesor.
• Grado IV- Sangre subaracnoidea difusa o no visible, pero con coágulos Intraparenquimatosos o Intraventriculares.
A estos pacientes con diagnóstico positivo de HSA se le indicarán de inmediato las siguientes investigaciones o exámenes complementarios: Hemograma completo, coagulograma completo, grupo sanguíneo y factor RH, ionograma (puede haber hiponatremia por síndrome de secreción inadecuada de hormona antidiurética (ADH) o incapacidad renal de retener sodio por disfunción de la regulación neurovegetativa. electrocardiograma.
Categorización o clasificación de los pacientes con diagnóstico positivo de HSA
Son diversas las clasificaciones utilizadas, que guardan valor pronóstico, entre ellas están: la de Botterell; la de Nishioka (versión modificada de la anterior); estudio cooperativo; Alvord, de la Federación Mundial de Neurocirujanos, de Sano y Tamura y otras; pero no son utilizadas en nuestro medio. A nuestros pacientes se les aplicará la escala de Hunt y Hess, por su amplia aceptación internacional.
Clasificación del estado neurológico de los pacientes con HSA
(Hunt y Hess, 1968). Comprende las siguientes categorías:
• Grado I- Asintomático, o cefalea discreta y ligera rigidez de nuca.
• Grado II- Cefalea moderada o severa, rigidez de nuca sin defecto neurológico, excepto la disfunción de alguno de los nervios craneales.
• Grado III- Somnolencia, confusión o defecto focal ligero.
• Grado IV- Estupor, coma, hemiparesia moderada o marcada, rigidez de descerebración temprana y trastornos neurovegetativos.
• Grado V- Coma profundo, rigidez de descerebración, aparentemente moribundo. En 1979 se introducen modificaciones a esta escala, aceptándose además: Grado 0- Aneurisma no roto, y el Grado I-A- Igual al I, pero con déficit neurológico fijo.
Una vez clasificados según esta escala, los pacientes con diagnóstico positivo de HSA serán admitidos en las Unidades de Cuidados Intensivos (UCI-C o UCI-P):
Criterios de admisión de los pacientes con HSA en UCI-C: Casos de HSA en grados I, II y III de Hunt y Hess. Casos de HSA en grados IV y V mayores de 60 años de edad.
Criterios de admisión de los pacientes con HSA en UCI-P: Casos de HSA en grados IV y V de Hunt y Hess, menores de 60 años. Casos que requieran tratamiento con la modalidad de hipertensión hipervolémica y hemodilución (triple H) de entrada, o que estando en UCI-C empeoren y requieran esta modalidad de tratamiento.
Tercera etapa: Diagnóstico etiológico. El diagnóstico etiológico de certeza o precisión se realiza con la obtención de la evidencia imagenológica de la lesión vascular cerebral (aneurisma único o aneurismas múltiples, o de MAV cerebral) mediante: angio-TC en equipo con suficiente poder resolutivo para ello, preferiblemente en tomografía computarizada (TC) multicortes (64 cortes), o en su defecto por angiografía de sustracción digital, o en última instancia (por déficit de los anteriores) mediante estudio angiográfico cerebral convencional. La coordinación con el departamento de imagenología se hará por parte de la unidad en la cual se encuentre ingresado el paciente.
Angio-TC Cerebral: Medio diagnóstico de elección. Momento de realización del estudio, urgencia inmediata o relativa, pues posibilita el diagnóstico previo al período de mayor incidencia de complicaciones. Preferiblemente en equipo multicortes (64 cortes con bomba de infusión acoplada para seriografía), que no sólo permite la visualización integral de los vasos del polígono e identificar la lesión vascular cerebral que sangró, sino que también posibilita la sustracción de otras estructuras anatómicas y así obtener la imagen tridimensional del árbol vascular cerebral, haciendo posible adicionalmente “colocar” la lesión a operar (aneurisma) mediante programación “virtual” tal y como será vista durante el abordaje quirúrgico, desde la perspectiva del cirujano, así como “descubrirá” los escollos que enfrentará el neurocirujano durante la operación para realizar el presillamiento del saco, por la interposición de asas y ramas vasculares vecinas, relaciones caprichosas y variables de diferentes estructuras, etc.
Por déficit de disponibilidad de angio-TC cerebral en equipo multicortes se obtendrá el diagnóstico etiológico mediante Angiografía cerebral, siendo las malformaciones vasculares cerebrales el 70 % de las causas de HSA, sólo el estudio angiográfico completo (de las 4 arterias; carótidas y vertebrales), permite el diagnóstico correcto y preciso. Momento de realización: urgencia inmediata o relativa (24- 48 horas después de la HSA). Se hará lo más pronto que sea posible tras el ingreso. Esta concepción posibilita el logro del diagnóstico previamente al período de mayor incidencia de complicaciones. Principios técnicos: Para el diagnóstico óptimo requiere de las vistas necesarias, compresión contralateral u otras maniobras para establecer patrones de flujo, seriografía, biplano, sustracción de imágenes. Efectividad en el diagnóstico positivo: (93- 95 %) Pueden existir lesiones aneurismáticas o pre- aneurismáticas no objetivizables angiográficamente u otros tipos de lesiones capaces de provocar HSA que no son diagnosticables por este estudio.
Tratamiento: Incluye tres etapas: pre-operatorio; quirúrgico y post-operatorio.
Primera etapa de tratamiento: Tratamiento pre-operatorio (incluye el tratamiento de las complicaciones pre- operatorias).
Comienza desde el mismo momento del diagnóstico positivo, en el servicio de urgencias. En estos departamentos, y en dependencia del estado en el cual se encuentre el paciente, se garantizará:
1. Control estricto de la TA (normotensión).
2. Vía aérea permeable y ventilación adecuada. De ser necesario, se intubará al paciente (pacientes con Glasgow < 8 puntos y con trastornos ventilatorios). Al intubar se debe sedar previamente al paciente y aplicársele lidocaína en la vía aérea superior, para evitar aumentos bruscos de la TA, que pueden provocar un nuevo sangramiento.
3. Garantizar vía venosa, periférica o profunda, en dependencia del estado del paciente.
4. Hidratación con NaCl al 0,9 %.
En las Unidades de Cuidados Progresivos (UCI-C y UCI-P) se garantizará:
1. Medidas generales: reposo absoluto en cama durante el período pre- operatorio, cabeza elevada 30º sobre el plano horizontal, iluminación y ventilación adecuadas, eliminación de ruidos, oxigenoterapia según necesidad (O2 a 4 L/ min.), laxantes, Sondaje vesical si fuese necesario, control hidroelectrolítico y ácido-básico (normovolemia), signos vitales y neurológicos cada 2 horas, adecuado aporte nutricional: proteico, calórico y vitamínico.
2. Sedación ligera si existe excitación psicomotora.
3. Analgésicos si existiese cefalea.
4. Tratamiento sintomático de náuseas y vómitos (vitamina B-6 parenteral, gravinol).
5. Profilaxis de convulsiones (si convulsiones durante el cuadro clínico): Difenilhidantoína Sódica.
6. Protectores de la mucosa gástrica (bloqueadores de receptores de histamina) cimetidina, ranitidina.
7. Control estricto de la TA: Normotensión arterial para evitar la ruptura del saco, sin comprometer la presión de perfusión cerebral (PPC). El objetivo es lograr una TA media entre 80 y 90 mm Hg, y evitar que la cifra de TA sistólica rebase los 160 mm Hg. y la de TA diastólica los 110 mm Hg.
8. Tratamiento de la hipertensión intracraneal, sólo si existiese (manitol, furosemida, esteroides).
9. Tratamiento preventivo contra el vasoespasmo: anticálcicos con efecto antivasoconstrictor selectivo cerebral (nimodipina y nicardipina).
Además de los pilares de tratamiento pre-operatorio mencionados, los casos con criterio de ingreso en UCI-P requerirán: ventilación controlada y modalidad terapéutica de hipertensión, hipervolemia y hemodilución (triple H) en los casos que requieran tratamiento intensivo por vasoespasmo (ver tratamiento de complicaciones).
Tratamiento de complicaciones pre-operatorias: complicaciones tempranas: (0-3 días); complicaciones mediatas: (4-14 días); complicaciones tardías: (más de 15 días).
Tratamiento de las complicaciones tempranas: edema cerebral (manitol, furosemida, esteroides); resangramiento (control de TA); hidrocefalia aguda (derivación de LCR); arritmias cardíacas (antiarrítmicos); trastornos ventilatorios (ventilación controlada).
Tratamiento de las complicaciones mediatas
• Vasoespasmo cerebral: Anticálcicos con efecto antivasoconstrictor cerebral selectivo como nimodipina y nicardipina. Hipertensión arterial con Hipervolemia y Hemodilución (Triple H): su objetivo es lograr el aumento de la presión de perfusión cerebral para garantizar la irrigación adecuada de las áreas en las cuales existe vasoespasmo. Se emplean soluciones coloides y cristaloides para expandir el volumen sanguíneo. Entre las primeras están: albúmina humana (presentación: bulbos de 50 ml al 20%, se emplean bolos de 250 ml de albúmina humana al 5% en solución salina cada 4 ó 6 horas); plasma fresco fraccionado; dextrán de bajo peso molecular (presentación: frascos de 50 grs. en 500 ml, 20 Mg. x Kg. en 24 horas a dosis fraccionadas). Entre los cristaloides se encuentran cloruro de sodio 0.9%; dextrosa 5% o glucofisiológico (dosis: 1.2 ml/Kg/hora). Con este esquema de tratamiento deben observarse los siguientes rangos en los parámetros: TA sistólica hasta160 mmHg. TA diastólica entre 100 y 110 mmHg. Presión venosa central (PVC) aproximadamente entre 10 y 12 mmHg. Presión en cuña de la arteria pulmonar (requiere de catéter de Swan Ganz) con límites máximos de 16-18 mmHg. Hto: entre 30 y 35 vol%. Drogas vasoactivas: Dopamina (200-400 Mg. en 500 ml de cloro sodio por vía endovenosa (EV) a la dosis entre 2.5 y 10 microgramos/Kg/min EV). Ajustar la dosis en relación a la respuesta. Isuprel (1-4 mg. en 250 ml de cloro sodio, EV; de2-4 microgramos/min). Ajustar la dosis en relación a la respuesta. Empleo de vasopresina si la diuresis es mayor de 200 mL/hora (5-10 unidades SC o IM. cada 4-6 horas).
• Resangramiento (control de la TA excesiva).
• Hiponatremia (control electrolítico).
• Hidrocefalia subaguda (derivación del líquido cefalorraquídeo (LCR).
• Neumonía (tratamiento específico y profilaxis).
Tratamiento de las complicaciones tardías
• Hidrocefalia crónica (derivación de LCR).
• Neumonía (tratamiento específico).
• Resangramiento (control de la TA).
• Vasoespasmo (ya visto).
• Trastornos hidroelectrolíticos (corrección).
Segunda etapa de Tratamiento. Tratamiento quirúrgico. Selección de pacientes como candidatos a tratamiento quirúrgico en nuestra provincia:
1. Aneurismas únicos ubicados en circulación anterior del Polígono de Willis.
2. Aneurismas múltiples ubicados en circulación anterior del Polígono de Willis.
Remisión de casos a servicios nacionales
1. Aneurismas localizados en la circulación posterior del. Polígono de Willis.
2. Aneurismas múltiples, uno de los cuales esté localizado en la circulación posterior.
3. Aneurismas únicos o múltiples, que incluya características que impliquen amplia complejidad técnica y que requieran de elementos tecnológicos no disponibles en nuestra provincia.
Momento de la operación. Aunque existen importantes divergencias de criterios en cuanto a la selección del momento óptimo para el acto quirúrgico, diversos estudios coinciden en seleccionar las primeras 72 horas, teniendo en cuenta que ello obvia el período de las complicaciones ulteriores, pero desfavorablemente el encéfalo se encuentra en condiciones adversas para el abordaje quirúrgico debido a lo reciente del sangramiento y al edema asociado, lo que se acompaña inevitablemente de mayor morbilidad quirúrgica. Los resultados reportados por la literatura acerca de las intervenciones después de los 14 días de sangramiento ofrecen una mortalidad muy similar a los operados antes de los 3 días, siendo más fácilmente accesibles desde el punto de vista quirúrgico las lesiones vasculares, con la desventaja de que ha transcurrido un período de complicaciones potenciales. Es reconocido que el período más desventajoso para la intervención quirúrgica es el comprendido entre los días 3 y 14 ulteriores al sangramiento, por coincidir las complicaciones isquémicas (vasoespamo), con la intervención quirúrgica, lo cual aumenta la morbimortalidad. En estos momentos se intervendrán los casos después de los 14 días.
Técnica quirúrgica
La técnica quirúrgica propuesta es el acceso directo al aneurisma y la oclusión del cuello del mismo. En los casos en que esto no sea posible se realizará el reforzamiento del saco empleando lámina de poliuretano esponjoso, sin acrílico. Se utiliza la incisión y craneotomía frontotemporopterional según el método clásico de Yasargil, con la modificación del propio autor para la conservación de la rama frontotemporal del nervio facial, durante la realización del colgajo epicraneal. Las intervenciones se realizarán con técnica microquirúrgica (bajo magnificación óptica). El paciente es colocado en posición supina con la cabeza fija en cabezal de Yasargil (4 puntos) deflexionada 15º hacia atrás y con un grado de rotación variable hacia el lado opuesto de la lesión a tratar, en dependencia de la ubicación exacta de la misma en el polígono de Willis:
Para aneurisma de Arteria Comunicante Anterior: rotación de 60º.
Para aneurisma de Arteria Carótida Supraclinoidea: rotación de 30º.
Para aneurisma de Arteria Cerebral Media: rotación de 45º.
Criterios de curación (pronóstico de curabilidad)
Categoría curación total: Se aplica a aquellos enfermos en los que ha sido posible excluir de la circulación todos los sacos aneurismáticos observados en los estudios imagenológicos de las 4 aferencias vasculares.
Categoría curación parcial: Se utiliza en los casos en los cuales se han presentado las siguientes eventualidades: paciente que no se estudió completamente desde el punto de vista angiográfico (en casos en que no se pudo realizar Angio-TC, y sólo se practicó angiografía convencional incompleta); paciente con aneurismas múltiples, y a quien no ha sido posible excluir de la circulación todos los sacos detectados; paciente con estados preaneurismáticos asociados, como dilataciones infundibuliforme, que pueden convertirse o ser asiento de aneurismas, y que no han sido tratados; paciente con aneurisma al cual sólo se le ha podido realizar reforzamiento de la pared; pacientes que mostraron un espasmo vascular marcado en la angiografía, y que sean operados sin haber repetido este examen, pues la estrechez arterial puede impedir el llenado de un aneurisma y por consiguiente no hacerse visible en ese momento; aquellos pacientes en quienes después de la oclusión del cuello queda un resto o muñón proximal del saco.
Tercera etapa de tratamiento: Tratamiento post-operatorio. Justificado por la magnitud de la intervención quirúrgica, y lo prolongado del tiempo anestésico, así como las complicaciones potenciales inherentes a la patología tratada (resangramiento y vasoespasmo), el seguimiento post-operatorio inmediato de estos pacientes debe realizarse en la UCI-P. Aquí se llevará a cabo el tratamiento específico de paciente sometido a cirugía vasculocerebral de gran envergadura, más la observación estrecha y tratamiento preventivo del vasoespasmo post-manipulación quirúrgica, para lo cual debe mantenerse con normovolemia e hipertensión moderada. En caso de ocurrir un vasoespasmo post- quirúrgico, bien con el aneurisma clipado o presillado correctamente, se podrá instaurar la terapia Triple H, descrita anteriormente, pero como ya no existe riesgo de ruptura del aneurisma que limite la hipertensión, las cifras de ésta pueden llevarse hasta 200 mm Hg de TA sistólica y 130 mm Hg de TA diastólica, la PVC puede llegar hasta 10 mm Hg y la PCAP hasta 20 mm Hg. Deberá además vigilarse la aparición de otras complicaciones inherentes a cualquier post- operatorio de envergadura, como son las infecciones, complicaciones respiratorias y cardiovasculares, desequilibrio hidroelectrolítico, entre otras, así como las propias de la patología a tratar, como son la isquemia cerebral, resangramiento, trastornos del control hipotalámico, entre otras.
GUÍA DE EVALUACIÓN