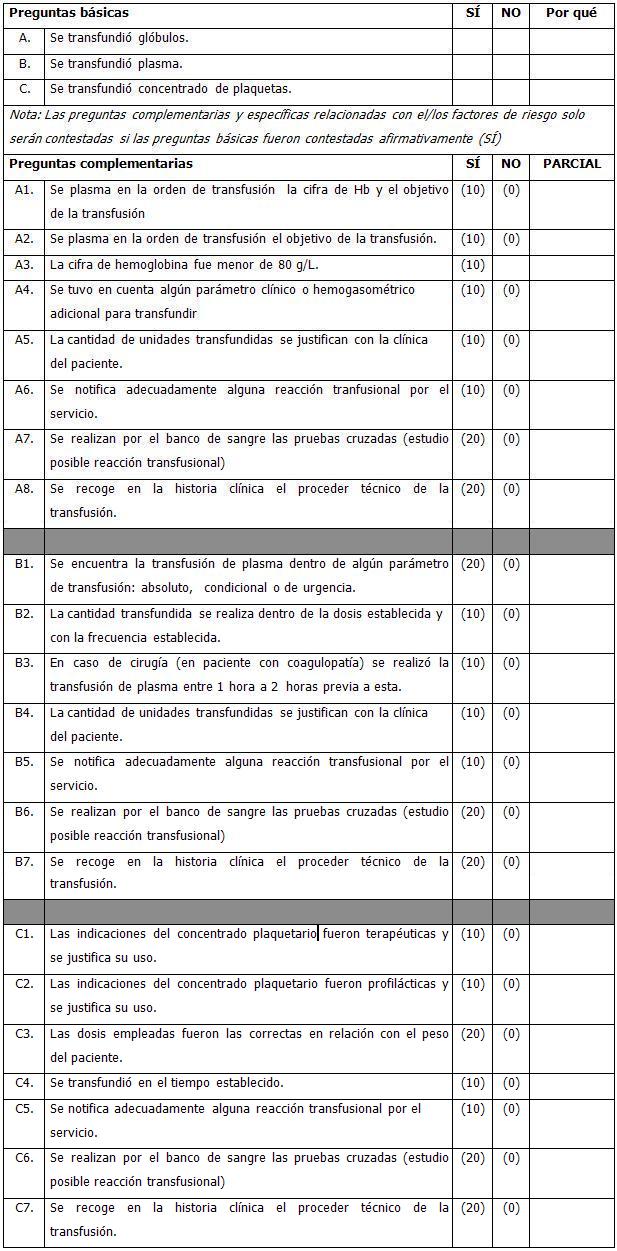
ANTECEDENTES
La anemia es un denominador común en hasta el 95 % de los pacientes que ingresan en unidades de cuidados intensivos, principalmente a partir del tercer día. Por ello, entre el 37 y 44 % recibe transfusión con concentrado de hematíes.
La tasa de transfusión está íntimamente ligada a las extracciones de sangre y al tiempo de estancia en la UCI y se correlaciona también, de forma directa, con la edad y gravedad del paciente. El nivel de hemoglobina por el cual los intensivistas prescriben la transfusión es universal, y ronda los 8,5 g/dL. La calidad de la sangre varía entre Europa y América. El tiempo de almacenamiento de la sangre transfundida es diferente. En Europa, la sangre transfundida es más "joven" de 16,2 ± 6,7 días y con frecuencia reducida de leucocitos. En contraste, en América, la sangre es más "vieja", de 21,2 ± 11,4 días de almacenamiento medio y la desleucocitación es mucho menos común.
De lo antes expuesto se puede resumir que la sangre total y sus componentes es la medida terapéutica de más rápido y de mayor impacto cuando está correctamente indicada y administrada. Por tanto, el intensivista en su practica profesional debe ser un coherente empleador de la buena y prudente práctica de la medicina transfusional.
TRANSFUSIÓN DE GLÓBULOS
La sangre total fresca
La sangre total aporta capacidad de transporte de O2 , factores estables de la coagulación cuando tiene menos de 6 horas de extraída y corrige la hipovolemia. En la actualidad su uso se encuentra bastante limitado y se reserva para situaciones tales como:
- Pérdidas agudas de más de un 20 % de la volemia.
- En exanguinotransfusión.
- En sangrados severos cuando no existen otros componentes.
- Cirugía cardio - pulmonar con circulación extracorpórea.
No está indicado: Como expansor de volumen.
Tener presente que ante estas situaciones lo más prudente es emplear inicialmente sustancias cristaloides o coloides e individualizar en dependencia de los parámetros hematológicos encontrados en los exámenes de laboratorio sustituyendo con concentrado de glóbulos y otros componentes como, plaquetas, plasma etc.
Dosis: En situaciones de extrema urgencia debe de transfundirse a tanta velocidad como lo requiera y tolere el paciente.
Concentrado de eritrocitos (CE)
El concentrado de eritrocitos se obtiene después de que la sangre total ha sido centrifugada y separado el plasma. El objetivo de su empleo es mejorar la capacidad de transporte de oxígeno sin el peligro de aumentar la volemia. En la actualidad las indicaciones más adecuadas para el empleo de concentrado de eritrocitos son las siguientes:
- Anemia sintomática en un paciente normovolémico independientemente de sus cifras de hemoglobina. El estado clínico y no el resultado de laboratorio es el elemento más importante a la hora de tomar esta decisión.
- Pérdidas agudas de sangre con más de un 20 % de pérdida de la volemia o con menos de un 20 % en un paciente con cifras previas de 100 g/L o que exista una enfermedad de base que descompense desde el punto de vista cardiovascular al paciente. Esta transfusión siempre debe ser acompañada de cristaloides y coloides para que su eficacia sea mayor.
- La transfusión perioperatoria , la práctica de la anestesia quirúrgica a sido guiada por la práctica empírica de una cifra de hemoglobina superior a 100 g/L o hematocrito menor de 30 %, cuando en realidad lo que se debe tener en cuenta son múltiples factores como: duración de la anemia, volumen intravascular, extensión de la cirugía, probabilidad de pérdida masiva de sangre, y comorbilidad asociada, enfermedad pulmonar, cardiopatía isquémica, enfermedad cerebrovascular, etc.
- La cifra de 80 g/L es adecuada para la cirugía en pacientes sin previos antecedentes de enfermedad.
- En complicaciones de la drepanocitosis como, crisis aplásica, crisis hepática mixta y de secuestro, síndrome toráxico agudo, crisis del SNC.
- Con cifras de hemoglobina menor o igual a 80 g/L en un paciente bajo régimen de quimioterapia o radioterapia o en pacientes con enfermedades cardiovasculares.
Dosis de administración y procedimientos
Dosis: de 10 a 15 ml / kg., no exceder de 2 unidades de concentrado de eritrocitos en 24 horas en pacientes con anemia crónica. La sangre deberá ser transfundida en un periodo no mayor de 4 horas. En pacientes ancianos se deben transfundir bajos volúmenes y de ser necesario sentar y administrar diuréticos previo a la transfusión.
En caso de pacientes Rh negativo, de no existir sangre compatible y situación de extrema gravedad se puede transfundir con sangre incompatible empleando la Ig - anti D a razón de 300ug por vía SC por cada 15 ml. de sangre incompatible infundida.
COMPONENTES CELULARES ESPECIALES
Concentrado de eritrocitos desleucocitados o pobre en leucocitos (CEPL)
La presencia de leucocitos en los concentrados de hematíes puede ser causa importante de reacciones adversas, por la presencia de antígenos leucocitarios del sistema mayor de histocompatibilidad. Los distintos filtros empleados para disminuir leucocitos pueden reducir entre un 70 a un 90 % la presencia de ellos en estos preparados y sus indicaciones son las siguientes:
- Prevenir la reacción febril no hemolítica recurrente.
- Prevención o retraso de la aloinmunización por antígenos leucocitarios.
- Prevenir la refractariedad plaquetaria.
- Prevenir la transmisión de virus intraleucocitarios.
- Prevención de la enfermedad pulmonar aguda por transfusión.
Concentrado de leucocitos lavados
Este proceso elimina la mayor parte de las proteínas plasmáticas, microagregados y citocinas así como cantidades variables de leucocitos y plaquetas. Su mayor desventaja es que su vida es limitada a 4 horas y que ocurren pérdidas de hematíes de hasta un 15 a 20 %. Sus principales indicaciones son:
- Paciente con historia de reacción anafiláctica a los componentes de la sangre o reacciones urticarianas severas.
- Pacientes con déficit selectivo de IgA y anticuerpos anti IgA documentados.
- Prevención de aloinmunización leucoplaquetaria y la reacción febril no hemolítica cuando no se dispone de CEPL.
- Reacciones febriles no prevenibles con la administración de CEPL.
- Púrpura aloinmune neonatal.
Otros componentes especiales como, los hematíes congelados, los componentes libres de citomegalovirus y los componentes irradiados no son indicaciones de la UCI por lo que solo consideramos mencionarlos.
En la actualidad una opción a la transfusión de glóbulos en el paciente en estado crítico lo constituye el uso de la Eritropoyetina recombinante la cual se utiliza a razón de 200 a 400 UI x Kg. SC en días alternos o 40 000 a 60 000 UI EV en 100 ml de SSF 0,9 % semanal durante 4 a 8 semanas.
Elementos a considerar antes de transfundir al paciente en estado crítico:
- La seguridad de los componentes sanguíneos es muy alta, pero la transfusión no está exenta de riesgo.
- Es importante que cada paciente sea evaluado individualmente, con el objeto de establecer concentración de Hb es un buen indicador, aunque debe valorarse conjuntamente con otras variables (edad, comorbilidad, diagnóstico actual, causa de la anemia y presencia de enfermedad cardiovascular).
- La evidencia científica disponible apunta a que en las estrategias transfusionales el correcto establecimiento está en la relación riesgo: beneficio. La transfusión sólo debería indicarse cuando esta relación sea favorable.
- No existe un umbral transfusional universal para el enfermo en estado crítico. Las estrategias restrictivas son iguales o mejores que las estrategias transfusionales liberales.
- La transfusión no siempre incrementa el consumo tisular de oxígeno, indicación más aceptada para transfundir.
- Nuevos indicadores transfusionales, basados en el nivel de oxigenación tisular, pueden complementar a la hemoglobina a la hora de decidir una transfusión.
- En pacientes en estado crítico, con normovolemia y sin enfermedad cardiovascular asociada, el umbral transfusional puede situarse en los 70 g/L de Hb.
- La exposición a diferentes antígenos que conlleva una transfusión sanguínea influye en el funcionamiento del sistema inmunitario del receptor (inmunomodulación).
- Las consecuencias de la inmunomodulación para los receptores de transfusión no están bien establecidas, aunque parece claro que la transfusión está asociada a un mayor riesgo de infección pos- operatoria. La influencia sobre la recurrencia del cáncer no está clara.
- La conservación de la sangre comporta la aparición de importantes cambios en los hematíes (lesión por almacenamiento), aunque la trascendencia de estos cambios para el receptor aún no está lo suficientemente establecida.
- La transfusión de hematíes de menos de 15 días de conservación a los pacientes en estado crítico, aunque podría ser una solución, aún no está suficientemente apoyada por la evidencia científica y representa un problema para los servicios de transfusión.
TRANSFUSIÓN DE PLAQUETAS
Concentrado de plaquetas (CP)
Los concentrados plaquetarios pueden obtenerse a partir de una centrifugación suave de plasma fresco o por métodos de aféresis. El concentrado de plaquetas que se obtiene a partir de una unidad de sangre total contiene entre 0,55 a 0,75 x 1011 plaquetas en 40 a 60 ml de plasma y en condiciones fisiológicas en un hombre promedio de 70 Kg. se espera que eleve el nivel de plaquetas entre 5000 a 10 000 x mm3 .
Indicaciones
Las indicaciones de los concentrados de plaquetas pueden ser profilácticas y terapéuticas y los criterios a tener en cuenta para su indicación son los siguientes:
Uso profiláctico:
Trombocitopenia hipoproliferativa con:
- Recuento plaquetario menor o igual a 10 x 109 / L, sin sangrado.
- Recuento plaquetario menor o igual a 20 x 109 / L, con factores predisponentes asociados y que agravan la trombocitopenia o favorecen el sangrado: sepsis, fiebre, esplenomegalia, lesión anatómica, uso de anticoagulantes, Coagulación intravascular diseminada (CID) u otras coagulopatías.
- Recuento plaquetario menor o igual a 50 x 109 / L en cirugía mayor o proceder invasivo.
- Recuento plaquetario menor o igual a 100 x 109 / L y intervención quirúrgica del SNC.
- En pacientes con leucosis agudas y con recuentos elevados de células blásticas en sangre periférica deben mantenerse cifras por encima de 50 x 109 / L .
- En pacientes con disfunción plaquetaria en caso de cirugía inminente, parto, proceder invasivo, individualizando en cada caso.
Uso terapéutico:
- Síndromes hemorrágicos en el curso de las trombocitopenias severas, en estos casos constituye una meta razonable mantener cifras de plaquetas por encima de 40 x 109 / L.
- En pacientes en CID o transfusión masiva y un recuento de plaquetas no disponible o inferior a 50 x 109 / L.
- Sangrado microvascular difuso que se presenta con posterioridad a una cirugía de derivación cardiopulmonar o balón intraaórtico y recuento plaquetario no disponible o menor de 100 x 109 / L.
- Sangrado microvascular y disfunción plaquetaria con tiempo de sangrado prolongado.
- En trombocitopenia aloinmune con menos de 10 x 109 / L de plaquetas en presencia de sangrados graves y cuando se precisa esplenectomía de urgencia o cirugía del SNC, acompañado de IgG intravenosa a razón de un 1g/ kg. / día / 2 días.
Dosis de administración y procedimientos
1 unidad = 1 bolsa
La dosis es a razón de una unidad por cada 10 / kg. de peso o 4 unidades/ m 2 .
El pico máximo de acción de la administración de plaquetas se produce 1 hora después de infundidas.
Velocidad de infusión rápida entre 20 a 30 minutos.
La refractariedad a la transfusión de plaquetas, se establece después de 2 transfusiones de concentrados ABO compatibles, las cuales resultan ineficaces.
La eficacia se determina por el incremento del recuento plaquetario corregido (IRC):
IRC = cuenta pretransfusión - cuenta postranfusión / Número de plaquetas transfundidas x 10 11 . La cuenta corregida debe ser superior a 7,5 x 10 9 /L. De no ser así estamos en presencia de una refractariedad.
La opción terapéutica en este caso será el Factor VII activado a razón de 90 a 120 ug/ kg. cada 3 horas por vía IV.
Contraindicaciones del uso de plaquetas
- Trombocitopenia inducida por heparina.
- Púrpura trombocitopénica trombótica y síndrome hemolítico urémico, excepto cuando exista sangrado con peligro para la vida.
- Hemorragia secundaria a trastornos de los factores de la coagulación.
- Pacientes con Púrpura trombocitopénica inmunológica (PTI) sin sangrado grave.
Precauciones en la administración:
No debe de administrase concomitantemente con el Anfotericin B sino en las primeras 4 a 6 horas posteriores a este.
CONCENTRADOS DE GRANULOCITOS
El uso de los concentrados de granulocitos ha disminuido grandemente en los últimos años con el surgimiento de los factores estimuladores de colonias, no obstante reseñamos sus principales indicaciones.
- Pacientes con neutropenia de 0,5 x 109 /L e infección bacteriana severa, que a las 48 horas no responde a tratamiento antibiótico convencional.
- Pacientes con disfunción granulocítica documentada y sepsis bacterianas progresivas.
Dosis de administración y procedimientos
La dosis es de una unidad diaria, lo que equivale para un individuo de 70 kg. a 1,5 x 10 8 neutrófilos por kg.. de peso, muy por debajo del recambio diario. En la actualidad la aparición de los factores estimuladores de colonias ha desplazado el empleo de estos concentrados. En nuestro medio se encuentra disponible el Leukocim y Hebervital los cuales equivalen 300 ug/ ml de factor estimulador de colonias granulocitícas CSF - G y las dosis es de 5 a 10 ug/kg. hasta que se restablezca la neutropenia.
PLASMA FRESCO CONGELADO (PFC)
El PFC está compuesto por agua, electrolitos, albúmina, globulina, factores de la coagulación y otras proteínas. La mayor parte de los factores de la coagulación son estables a la temperatura de refrigeración excepto los factores lábiles como el factor VIII y V, que para su conservación requieren que el plasma se conserve a 25 0 C o menos, dentro de las 6 horas posteriores a la extracción.
FunciónAporta los factores indispensables para llevar a cabo la hemostasia que incluye a factores que participan en la hemostasia primaria (fibronectina, agonistas plaquetarios), coagulación (factores de la coagulación), fibrinólisis (plasmita, antiplasmina, etc) y proteínas anticoagulantes (antitrombina, proteína C, proteína S, etc).
Para uso clínico existen variantes de acuerdo a su preparación y conservación:
a) Plasma fresco congelado (PFC), que contiene el 70 % de los factores de coagulación.
b) Plasma desprovisto de crioprecipitado (PDC): Es el remanente después de haber separado los factores de coagulación que precipitan en frío (crioprecipitado) por lo que es pobre en factor VIII, factor de von Willebrand (vW), factor IX, fibrinógeno y fibronectina.
IndicacionesEl PFC debe ser usado únicamente para tratar episodios de sangrado y bajo ciertas situaciones en pacientes que se someterán a procedimientos quirúrgicos o invasivos.
Recomendaciones absolutas- Corrección de la deficiencia de un factor de la coagulación del cual no exista disponibilidad de un concentrado específico o combinado asociado a sangrado (deficiencia de factor II, V, VII, IX, X, XI).
- Deficiencia de factor XII y/o de anticoagulantes naturales (AT-III, Proteína C y Proteína S) que se asocian a trombosis.
- Para revertir en forma inmediata el efecto de los anticoagulantes orales, asociados con sangrado (para corregir los factores II, VII, IX y X) o con riesgo de sangrado ante la necesidad de un procedimiento invasivo o quirúrgico de urgencia.
- Deficiencia múltiple de factores de la coagulación como en las hepatopatías, síndrome hemodilucional, transfusión masiva.
- Coagulación intravascular diseminada
- Procedimientos de recambio plasmático en la púrpura trombocitopénica trombótica (PTT).
- Microangiopatía trombótica: Síndrome urémico hemolítico y PTT; en esta última se recomienda el uso de plasma desprovisto de crioprecipitado.
Uso condicional del PFC en presencia de sangrado y anormalidades de la coagulación
- Transfusión masiva (reemplazo equivalente o mayor a 1,5 volumen sanguíneo total en 24 horas).
- Ocasionalmente para proveer otros constituyentes del plasma, como el inhibidor de C-1 esterasa en el edema angioneurótico hereditario.
Uso de urgencia (excepcional)
- Tratamiento inicial de episodios hemorrágicos, en pacientes sin diagnóstico confirmado del tipo de hemofilia (Hemofilia A o hemofilia B) o bien en pacientes con hemofilia B y hemorragias que ponen en peligro la vida.
- Hipovolemia.
- Procedimientos de recambio plasmático (sin deficiencia de factores de la coagulación) excepto para tratamiento de PT.
- Apoyo nutricional.
- Hipoalbuminemia
- Tratamiento de inmunodeficiencias.
- Paciente asintomático con alargamiento de tiempos de coagulación o cuando la coagulopatía pueda ser corregida con tratamiento específico (por ejemplo vitamina K).
Dosis de administración y procedimiento:
El plasma se transfunde a razón de 10 a 20 ml /kg.
- Para obtener niveles hemostáticos adecuados, se recomienda que la transfusión de plasma se realice como máximo 2 horas antes del procedimiento quirúrgico.
- En general es suficiente administrar de 10 a 20 ml de PFC /kg. de peso corporal para lograr el nivel hemostático de 25 a 50 % de actividad de los factores de la coagulación. Para lograr una elevación cercana al 100 % se deben administrar 40 ml de PFC/kg. de peso corporal. Para fines prácticos el cálculo se debe realizar tomando en cuenta que cada ml de PFC contiene 1 UI de factor.
- Para el cálculo de las dosis subsecuentes se suman al 50 % de actividad por la vida media de los factores previamente transfundidos. De tal manera que como máximo se requiere repetir la dosis de 10 ml/kg. cada 24 horas del PFC o de PDC, sin embargo esto dependerá de la localización y severidad del sangrado y de la respuesta clínica del paciente.
- Una vez descongelado deberá transfundirse dentro de las siguientes 6 horas y no deberá recongelarse para uso terapéutico.
- Previa a la transfusión del plasma es recomendable practicar una prueba de compatibilidad menor o pruebas de rastreo de anticuerpos irregulares contra antígenos eritrocitarios de importancia clínica, en el donador.
Recomendaciones generales
- Dejar constancia de la transfusión y posibles reacciones en el expediente clínico.
- Realizar la transfusión a una velocidad que no exceda de 10ml/min.
- No administrarse con medicamentos u otra solución y mantener el sistema cerrado.
- Deberá ser transfundido con filtro de 170 a 210 m.
- Suspender de inmediato ante una reacción transfusional y llevar el componente sanguíneo al banco de sangre.
- Deberá existir el consentimiento informado firmado y la indicación médica justificada en el expediente clínico, en el que debe mencionarse: producto, volumen, tiempo de administración.
- Al momento de recibir la unidad a transfundir se deberá verificar que el componente sanguíneo cuente con fecha de extracción, fecha de caducidad, número de unidad, tipo de anticoagulante, volumen, tipo de producto, grupo sanguíneo, ABO y Rho (D), serología para VIH, HVB, HVC, sífilis y las que se implementen con el tiempo, todas negativas y que no presente datos de hemólisis, coágulos u otros.
CRIOPRECIPITADOS
Fracción proteica del plasma fresco congelado a temperatura de menos 70°C que se mantiene precipitado al descongelarse en condiciones controladas. Contiene un volumen entre 5 y 25 ml. y un mínimo de 80 UI de factor VIII en al menos el 75 % de las unidades estudiadas, de 150 a 250 mg. de fibrinógeno, del 20 al 30 % del factor XIII y del 40 al 70 % del factor von Willebrand presente en el plasma, además de fibronectina.
FunciónCorrección de la deficiencia de los factores de la coagulación I, VIII, Von Willebrand y XIII.
Indicaciones- Hipofibrinogenemia: Cuando el fibrinógeno < 100 mg/dl. y hay sangrado activo.
- Disfibrinogenemia.
- Coagulopatía de consumo.
- Uso tópico en forma de proteínas coagulantes (cola de fibrina).
- Para aportar fibronectina (discutido).
- Tratamiento de la hemofilia A, excepcional en casos de urgencia y ausencia del concentrado específico con doble inactivación viral.
- Enfermedad de Von Willebrand tipo 1,2 y 3; a excepción del tipo 2b, en ausencia desmopresina (DDAVP) y a falta de concentrado específico con doble inactivación viral.
- Deficiencia de factor XIII.
En reposición de factores de coagulación no contenidos en este componente.
Dosis de administración y procedimientoComo manejo primario se recomiendan los siguientes lineamientos:
Administración de factor VIII en el tratamiento de hemorragia en pacientes con hemofilia A
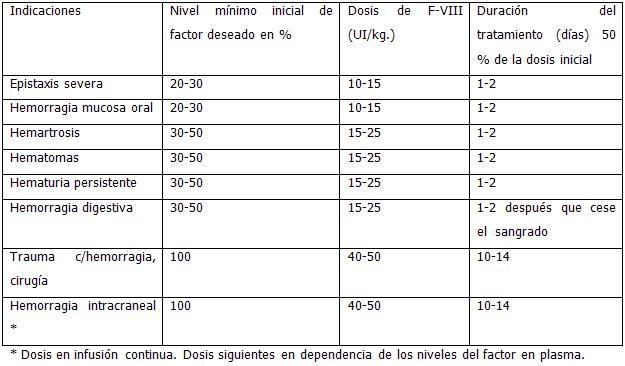
Dentro de la terapia alternativa se encuentra la desmopresina (DDAVP) la cual se usa como medida profiláctica en enfermos con hemofilia leve o moderada.
El reemplazo mediante los crioprecipitados debe de hacerse tomando en consideración que cada bolsa de crioprecipitado tiene en promedio de 80 a 100 UI de F-VIII.
La fórmula para el cálculo se realiza multiplicando el peso en Kg. x el % a elevar (ver cuadro anterior).
Por ejemplo: un paciente de 60 Kg. con una hemartrosis, deberá recibir una dosis inicial de: 60 x 15 = 900 UI que equivale a 9 bolsas de crioprecipitados.
Nota: En algunos bancos de sangre se acostumbra reconstituir los crioprecipitados en concentrados de 3 ó 5, por lo que cada bolsa contendrá 300 UI o 500 UI de factor VIII según sea el caso; esto deberá tomarse en cuenta en la dosificación.
FibrinógenoEn general 10 U (bolsas) de crioprecipitados incrementarán el nivel del fibrinógeno entre 80 y 100 mg/dl, en un adulto de talla promedio. En el caso del paciente urémico la dosis ha sido estandarizada empíricamente en 10 U, independientemente del peso del sujeto o el estado de la uremia.
El contenido de fibrinógeno en los crioprecipitados ha sido usado durante cirugía como una preparación hemostática tópica. Una o dos unidades de crioprecipitados son descongeladas y depositadas en una jeringa. En otra se coloca trombina (generalmente bovina) y cloruro de calcio. Luego el contenido de las dos jeringas son simultáneamente aplicadas a la superficie sangrante. El fibrinógeno en el crioprecipitado (algunas veces autólogo) es convertido en fibrina por la acción de la trombina.
Factor XIIIEn pacientes con deficiencia de factor XIII, la dosis promedio será de una unidad (bolsa) por cada 10 a 20 Kg. de peso cada 7 días ya que tiene una vida media de 6 a 10 días y se requiere de una pequeña cantidad para mantener la hemostasis.
Recomendaciones generales- Se recomienda que el grupo sanguíneo ABO sea igual al del receptor pero no necesariamente ya que el contenido de anticuerpos sanguíneos es muy bajo debido al proceso de obtención. No requiere pruebas de compatibilidad.
- En el banco de sangre, utilizando las buenas prácticas de manufactura, se descongelan entre 30 y 37o C en baño María dentro de una bolsa de plástico y se reconstituye, en caso necesario, con solución salina para un volumen de 10 ml. por bolsa. Generalmente se mezclan en forma aséptica y colectan en una sola bolsa el número de unidades que van a ser administradas.
- Deben de transfundirse antes de las siguientes 6 horas después de descongelarse para su transfusión.
- No administrar concomitantemente con medicamentos u otras soluciones.
- Realizar la transfusión a una velocidad que no exceda de 10 ml/minuto.
- Deberá ser transfundido con filtro de 170 a 210 m.
- Suspender de inmediato ante una reacción transfusional y llevar el componente sanguíneo al banco de sangre.
- Deberá existir el consentimiento informado firmado y la indicación médica justificada en el expediente clínico, donde se mencione, producto, volumen, tiempo de administración y efectos adversos si se presentaran.
- Al momento de recibir la unidad a transfundir se deberá verificar que el componente sanguíneo cuente con fecha de extracción, fecha de caducidad, número de unidad, tipo de anticoagulante, volumen, tipo de producto, grupo sanguíneo, ABO y Rho (D), serología para VIH, HVB, HVC, sífilis, y las que se implementen con el tiempo, todas negativas.
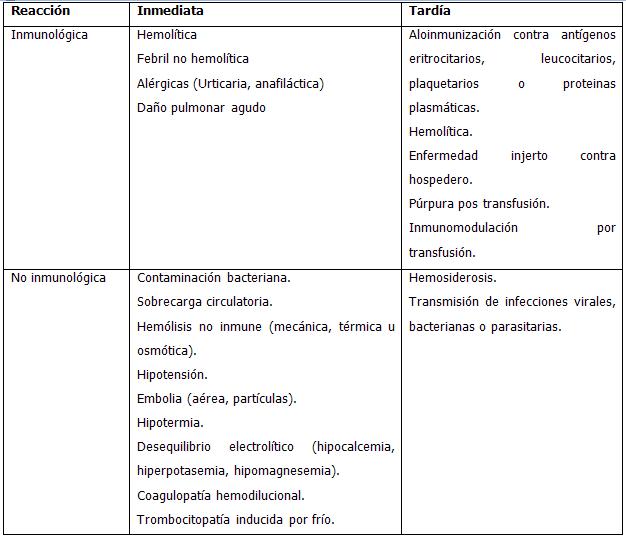
REACCIONES TRANSFUSIONALES
La transfusión de componentes sanguíneos se considera como un procedimiento relativamente seguro, inocuo y eficaz. Sin embargo, la terapia transfusional implica riesgo de reacciones adversas, desde leves hasta muy graves que incluso pueden provocar la muerte. Los riesgos de la transfusión se deben ponderar en comparación con los beneficios terapéuticos esperados. El personal de salud debe ser capaz de reconocer y manejar las diferentes reacciones adversas de la transfusión, y emplear los medios disponibles para eliminar o minimizar tales riesgos al enfermo.
DefiniciónEventos adversos asociados a la terapia transfusional, que pueden presentarse de manera inmediata o tardía. El término de reacción transfusional se refiere a la respuesta anormal o a efectos adversos que un paciente presenta o desarrolla con la administración de los diferentes componentes sanguíneos.
La reacción transfusional se considera inmediata cuando se presenta en las primeras 24 horas y tardía cuando se presentan después de este lapso.
ClasificaciónLas reacciones transfusionales se clasifican en dos grandes categorías: inmunológicas y no inmunológicas, ambas pueden ser inmediatas o tardías.
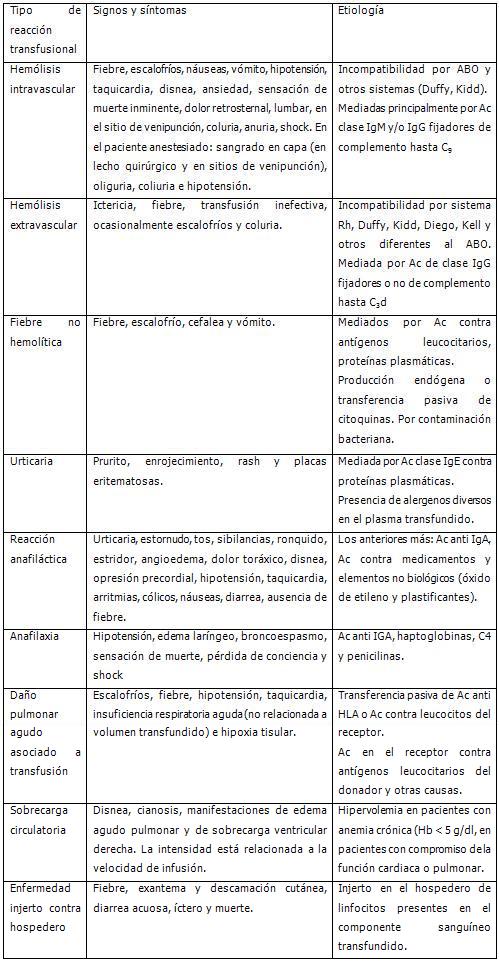
Manifestaciones clínicas y etiología de las principales reacciones transfusionales
Se puede orientar la sospecha diagnóstica de reacción transfusional (RT) a partir de los signos y síntomas presentes en el paciente. Es importante recordar que no todos los datos clínicos se manifiestan en todos los pacientes, ni con la misma intensidad.
Manifestaciones clínicas y etiología de las reacciones transfusionales
MANEJO
1. Detener la transfusión.
2. En reacciones leves puede administrarse un antihistamínico como la difenhidramina a dosis de 25 a 50 mg. cada 6 a 8 horas por vía oral, intramuscular o intravenosa.
3. Si la reacción no cede, se agrava o de inicio es grave, se debe administrar epinefrina a dosis de 0,3 a 0,5 mg. (0,3 a 0,5 ml de una solución 1:1000) por vía subcutánea, repitiendo cada 20 a 30 minutos hasta un máximo de tres dosis. Hidrocortisona de 100 a 500 mg. por vía intravenosa cada 6 horas. Si hay broncoespasmo dosis inicial de aminofilina de 6 mg /kg. por vía intravenosa en infusión en un periodo de 20 a 30 minutos, y dosis de mantenimiento de 0,5 a 0,6 mg/kg /hora en infusión por vía intravenosa en periodos de 20 a 30 minutos y el tratamiento de soporte que sea necesario (oxígeno, fluidos etc.), de acuerdo a la condición clínica del paciente.
4. Si la reacción cede y por las condiciones clínicas del paciente la transfusión es ineludible, podrá continuarse con esta disminuyendo la velocidad de infusión y con vigilancia estrecha de las condiciones del paciente.
5. Cuando la transfusión pueda diferirse es preferible cruzar nuevos productos y se utilizarán lavados, deficientes de IgA, o productos liofilizados según sea el caso.
6. Estudios de laboratorio.
GUÍA DE EVALUACIÓN