INTRODUCCIÓN
La enfermedad cerebrovascular (ECV) constituye un problema en la salud pública mundial. En Cuba y en países desarrollados representa la tercera causa de muerte, la primera causa de discapacidad, y la segunda causa de demencia en el adulto. (1-4) Afecta a un 50 % de la población mayor de 60 años. La Organización Mundial de la Salud ofrece cifras alarmantes: 15 millones de personas sufren ictus anualmente, de ellas, 5 millones mueren y otros 5 millones quedan con discapacidad permanente. (1, 4)
Un estudio epidemiológico reciente, evidencia que en Cuba en el año 2006, se produjeron 8347 muertes debidas a un ictus, para una tasa bruta de 74,0 y una tasa ajustada por grupos de edad, de 42,2 x 100,000 habitantes. El grupo de edad más afectado fue el de 65 años y más, las ECV constituyeron una causa importante de mortalidad prematura, con 16,1 x 100,000 habitantes en el 2002. (1)
El diagnóstico de ECV requiere de la evaluación clínica del enfermo, así como de estudios neuroimaginológicos, tales como: la tomografía axial computarizada (TAC) simple de cráneo, el ultrasonido Doppler, la TAC multicorte (AngioTAC y perfusión), difusión, perfusión, espectroscopia y tractografía por resonancia magnética (RM) y la tomografía por emisión de positrones (PET). Con la RM también pueden ser estudiados los vasos (AngioRM).
En el ictus isquémico, producto de la disminución del flujo sanguíneo y, por tanto, de la perfusión cerebral, se desencadena una cascada de procesos bioquímicos que dañan la integridad de la estructura neuronal y causan muerte celular, pero en su periferia queda una zona en la que las neuronas son potencialmente salvables. Es importante definir por imágenes el tejido isquémico viable, objeto de las medidas terapéuticas. (2) La eficacia del tratamiento trombolítico depende del tiempo de intervención (menor de 3 horas de comienzo del ictus), pues fuera de este tiempo, el daño neurológico se exacerba por repercusión. (2) De manera que el factor tiempo es primordial en estos pacientes. Los estudios neuroimaginológicos y la elevación sérica de los marcadores biológicos favorecen la confirmación del diagnóstico en el menor tiempo posible.
En el presente trabajo, mediante la revisión de artículos recientes y las argumentaciones acerca de los cambios bioquímicos que se producen en la isquemia cerebral -el aumento de ácido láctico, la excitotoxicidad, el edema citotóxico y vasogénico, la rotura de la barrera hematoencefálica, la liberación de citokinas proinflamatorias, entre otros-, y de cómo estos se traducen en las neuroimágenes, se pretende mostrar la utilidad de las técnicas neuroimaginológicas en el diagnóstico de las ECV y su vinculación con la neurobioquímica.
DESARROLLO
Neuroquímica y enfermedad cerebrovascular isquémica.
Al obstruirse una de las arterias cerebrales, el flujo sanguíneo en el territorio vascular afectado disminuye por debajo de un nivel crítico (de 55ml/100g/min a menos de 12ml/100g/min). Ello da lugar a una zona central severamente hipoperfundida (núcleo isquémico), donde el flujo sanguíneo cerebral (FSC) disminuye de 15 a 10 ml/100g/min, (2) en tanto que en la periferia se establece una isquemia menos pronunciada (entre 15 a 35ml/100g/min), llamada penumbra isquémica. En el núcleo isquémico, se produce daño celular irreversible y muerte celular aguda, principalmente por necrosis. (2, 5) En la penumbra isquémica se conserva una actividad metabólica mínima que preserva la integridad estructural neuronal, lo que la hace potencialmente reversible a la isquemia. Si no se toman las medidas terapéuticas adecuadas, se produce la muerte gradual de las neuronas de esta zona por apoptosis mediada por genes.
No todas las neuronas responden de forma similar a la isquemia, las neuronas del hipocampo, núcleo amigdalino, corteza cerebral y cerebelo, son más sensibles a la isquemia y sufren cambios estructurales más precozmente que las neuronas de otras localizaciones y que las células gliales. (5) Las más vulnerables a la isquemia son las situadas en el cuerno de Among sector 1 (CA1). (6) Se ha demostrado que un periodo de 5 minutos de isquemia es suficiente para producir daño neuronal irreversible en este sector, mientras que los astrocitos sufren daño después de un periodo isquémico de 30 a 60 minutos. (7) Un modelo de isquemia generada por oclusión de la arteria cerebral media demostró que un periodo isquémico de 40 minutos es suficiente para producir muerte neuronal, sin embargo los astrocitos requieren un periodo isquémico mucho mayor, aproximadamente 360 minutos. (6, 7)
En la interacción neuro-glial, los astrocitos desempeñan un papel fundamental en la tolerancia isquémica, neuroprotección endógena, establecimiento de la lesión definitiva y en la reparación tisular (gliosis). (7)
La elevación sérica de los marcadores biológicos en las primeras 6 horas de inicio del infarto cerebral (IC) son una herramienta útil para el diagnóstico, evolución y pronóstico de la ECV isquémica. Se ha demostrado que existe correlación entre la elevación plasmática de estos y la lesión del tejido neuronal, después de la oclusión de un vaso. (5)
Algunos de esos marcadores son: glutamato, marcador de exitotoxicidad; la proteína astroglial S-100, que se encuentra en altas concentraciones en las células gliales y de Schwann; (5, 8) la metaloproteinasa-9, marcador de rotura de la barrera hematoencefálica (BHE); la molécula de adhesión celular vascular (VCAM); la interleukina- seis (IL- 6) y el factor de necrosis tisular (TNF), marcadores de inflamación; la enolasa específica de neuronas (ESN), marcador muy sensible de daño neuronal (5, 9) y el factor de Von Willebrand, marcador de trombosis. (10)
López–Silva y colaboradores 2007 (4) demostraron que la creatinfosfokinasa (CPK) es un marcador biológico útil y que, a diferencia de los anteriores, es de bajo costo y está accesible en la mayoría de los centros hospitalarios. Esta es una enzima muscular y encefálica. La elevación de los niveles séricos (mayor de 80 U/L en mujeres y de 149 U/L en hombres) indica daño a músculo o cerebro. Específicamente la isoforma CPK I o BB se eleva en condiciones de infarto cerebral, estado de choque o tumor cerebral. Además, plantean que los niveles de CPK pueden permanecer elevados en sangre hasta 14 días después de un ictus, y que la enzima es útil en la evaluación pronóstica temprana de discapacidad, sobre todo en las primeras 12 horas. Los niveles mayores a 300 UI/L se relacionan con mal pronóstico y con mortalidad.
Los principales eventos bioquímicos en la cascada isquémica, el proceso inflamatorio post isquemia, la cascada de expresión génica y la acción de la glía en la isquemia cerebral, han sido bien estudiados y referidos en la literatura médica. (11, 12)
Es importante resaltar en este acápite el papel de las metaloproteinasas de matriz (MMP) en la ECV. Estas son una familia de enzimas proteolíticas (Zn-dependientes) que se encargan del remodelado de la matriz extracelular (MEC) y que en conjunto pueden degradar todos los constituyentes de esta. (13) Entre las MMP, la gelatinasa A (MMP-2) y la gelatinasa B (MMP-9), son capaces de digerir la lámina basal endotelial, fundamental en el mantenimiento de la BHE y en la transformación hemorrágica del infarto. (13)
Neuroimaginología y enfermedad cerebrovascular isquémica.
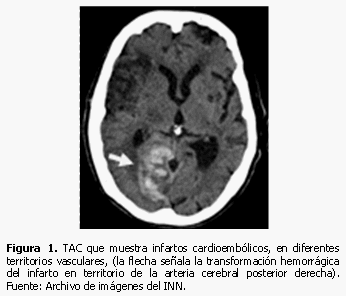
Las exploraciones imaginológicas ayudan a confirman el diagnóstico etiopatogénico del ictus isquémico. Los más frecuentes son el aterotrombótico, de grandes y pequeños vasos, y el cardioembólico. (14) La TAC de cráneo simple descarta la hemorragia cerebral y confirma el ictus isquémico, su localización y extensión. Sin embargo, la TAC puede no detectar, lesiones isquémicas en las primeras horas y si son pequeñas, como infartos lacunares y lesiones en fosa posterior, su sensibilidad disminuye aún más; (15) la resonancia magnética es el método idóneo en estos casos, si no hay contraindicación. El ictus de etiología cardioembólica se visualiza en la TAC, generalmente de localización cortical, en ocasiones hemorrágico o en forma de infartos múltiples en diferentes territorios vasculares (Figuras 1 y 2). Estos hallazgos y la presencia de cardiopatía embolígena, confirman el diagnóstico. El ictus isquémico de etiología aterotrombótica, exige para su diagnóstico la realización de ultrasonido Doppler y/o estudios angiográficos, ya sea angioTAC, angioRM (no invasivos), o angiografía (invasivo),(16) para detectar alteraciones de la pared arterial, tanto de vasos extracraneales supraaórticos, como intracraneales. La normalidad de los vasos en estos estudios excluye el diagnóstico.
La TAC de cráneo simple, el ultrasonido Doppler carotídeo/transcraneal y las secuencias convencionales de resonancia magnética nuclear (T1, T2 y FLAIR) son las técnicas más empleadas en nuestro medio en el diagnóstico de la ECV isquémica. Las técnicas novedosas de imágenes aunque brindan mayor información no están disponibles en la mayoría de nuestros centros hospitalarios. Sin embargo, es necesario conocer su existencia y fundamento neurobioquímico, como un modo de mantener la actualización con respecto a lo que acontece en materia de neuroimágenes en relación con el diagnóstico y tratamiento del ictus isquémico, en países del primer mundo.
Neuroimaginología su relación con los cambios neurobioquímicos en la isquemia.
En varios estudios revisados se demuestra que los cambios bioquímicos que se producen en la isquemia y que llevan a neurotoxicidad e inflamación del tejido cerebral, son útiles como marcadores moleculares y se asocian con: signos tempranos de la isquemia en las neuroimágenes, deterioro neurológico, volumen del infarto, transformación hemorrágica del infarto y con el síndrome isquémico maligno. Además permiten valorar la eficacia del tratamiento trombolítico. (17)
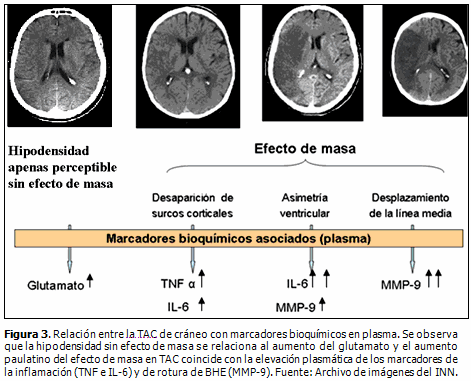
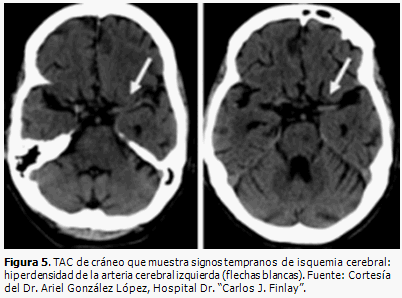
En TAC la hipodensidad temprana sin efecto de masa se relaciona con un incremento de glutamato; el aumento de las concentraciones de citocinas y metaloproteinasas en el plasma se asocia con grados superiores de edema cerebral. (18) (Figura 1)
Se ha reportado la asociación secuencial de los marcadores de excitotoxicidad (glutamato), inflamación (TNF-a e IL-6) y ruptura de la BHE (MMP-9) (Figura 3) de acuerdo con la intensidad de los marcadores tempranos de la isquemia cerebral, con un alto índice de probabilidad. (17)
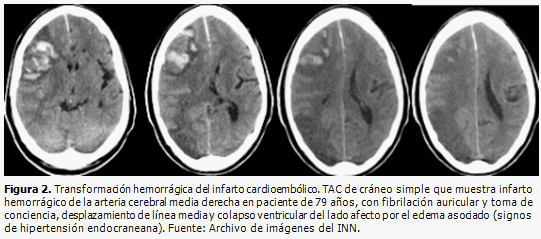
Montaner y colaboradores (13) demostraron que hay una sobreexpresión de MMP-9 en la fase aguda del ictus isquémico en humanos, mientras que los niveles de MMP-2 son máximos en el momento basal y los de MMP-9 alcanzan su pico a las 24 horas, lo que asegura una correlación entre la expresión de MMP-9, la situación neurológica del paciente y la magnitud del infarto cerebral en la fase aguda. La transformación hemorrágica en el ictus cardioembólico está relacionada con las metaloproteinasas (Figura 2), los niveles basales aumentados de MMP-9 influyen en la aparición de un infarto hemorrágico en fase tardía. También existe relación entre la expresión de MMP y la de citocinas proinflamatorias, IL-6, en la isquemia cerebral. (13, 17, 18) En el mismo estudio de Montaner la localización, tamaño, extensión y/o transformación hemorrágica del infarto fueron corroborados por TAC. (13)
En lo adelante se describen los hallazgos más importantes que podemos encontrar mediante las técnicas imaginológicas, tanto en las más empleadas en Cuba como algunas de las novedosas, basadas en el fundamento fisiopatológico de las alteraciones visibles en cada estudio.
Ultrasonido Doppler
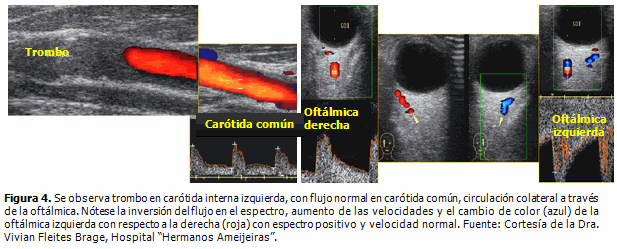
El ultrasonido Doppler es un método no invasivo y está disponible en la mayoría de los hospitales. No implica riesgos y es útil en la prevención de la ECV; además, adquiere especial importancia en la vigilancia de la ateroesclerosis, sobre todo con respecto a su diagnostico precoz. Es el único que permite el estudio detallado de la pared vascular, del complejo miointimal en tiempo real y el análisis de la dirección, velocidad y características del flujo. Pueden visualizarse trombos que ocluyen los vasos extracraneales (Figura 4) en el momento agudo del ictus, mediante lo cual puede llegarse a la causa de la disminución del FSC. (19)
Tanto el ultrasonido Doppler como el Doppler transcraneal (DTC) permiten la evaluación no invasiva de la circulación cerebral al determinar parámetros de flujo en las principales arterias intracraneales y de las vías de circulación colateral en las lesiones vásculo-oclusivas del encéfalo (Figura 4). La combinación de ambos métodos, (DTC/carotídeo), tiene una elevada sensibilidad y especificidad.
Mediante este método puede obtenerse no sólo la localización de la oclusión, sino también la precisión del momento en que ocurre, el grado de recanalización del vaso, así como de la posible reoclusión. En este sentido se ha reportado que existe un alto nivel de correlación entre los hallazgos eco-espectográficos y los de la angiografía. (20, 21)
El DTC también posee valor terapéutico (sonotrombolisis) utilizado 2 MHZ, combinado con el activador del plasminógeno tisular por vía endovenosa, lo que ha sido demostrado por varios ensayos clínicos. (22-24) Igualmente, puede ser de ayuda en la detección de microembolias cerebrales, por lo que debe realizársele a todo paciente con ictus isquémico.
Tomografía axial computarizada de cráneo
La TAC simple es utilizada como método de exploración en urgencias, por ser más rápido, seguro y no tener contraindicaciones. Es el primer examen que debe ser realizado inmediatamente ante la sospecha de ECV para definir si se trata de una ECV hemorrágica o isquémica, y el primer paso importante en el manejo del ictus agudo, pues las estrategias terapéuticas para cada caso difieren totalmente. La TAC permite identificar la presencia de lesión subyacente, tumor, hematoma subdural o malformación vascular.
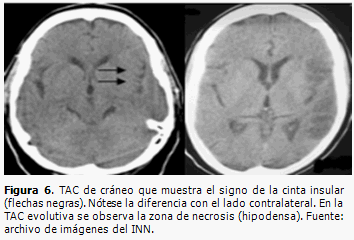
En las primeras horas de un infarto cerebral, la TAC de cráneo puede ser normal o mostrar signos precoces de infarto (Figuras 5 y 6) que serán de gran ayuda para valorar la extensión del infarto e instaurar un tratamiento trombolítico.
La TAC muestra la evolución del efecto de masa que se produce en la isquemia, por edema e inflamación. En las primeras horas debido al edema citotóxico y a la liberación de citocinas proinflamatorias, TNF y la IL-6, y después al edema vasogénico que alcanza su mayor magnitud entre el segundo y tercer día, causante de un incremento de volumen de alrededor de 8 ml. Si el infarto es extenso, el volumen del tejido cerebral aumenta y se puede producir herniación de las estructuras cerebrales, siendo esta la complicación más peligrosa del proceso isquémico agudo. (2) El efecto de masa puede comprimir los capilares del tejido adyacente y extender la isquemia. El efecto de masa crece paralelamente con el edema, entre los primeros tres a siete días y se estabiliza durante la segunda semana. (25)
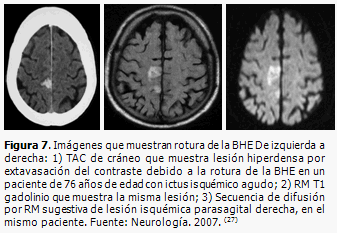
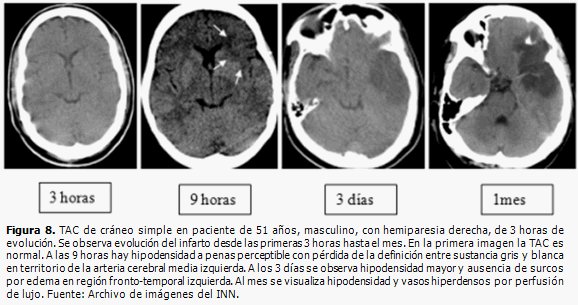
La TAC y la RM de cráneo contrastadas, permiten visualizar la rotura de la BHE (Figura 7), con extravasación del contraste hacia el parénquima cerebral, pues si la barrera estuviera intacta el contraste circula por el interior de los vasos y no se extravasa. En el proceso de reparación, los vasos de neoformación son fenestrados, después maduran; la BHE es de utilidad transcurridos aproximadamente 3 meses después del evento. En ocasiones, pueden ser visualizadas en TAC de cráneo simple, imágenes hiperdensas dentro de la hipodensidad del área isquémica, lo que se corresponde con perfusión de lujo. (26) (Figura 8).
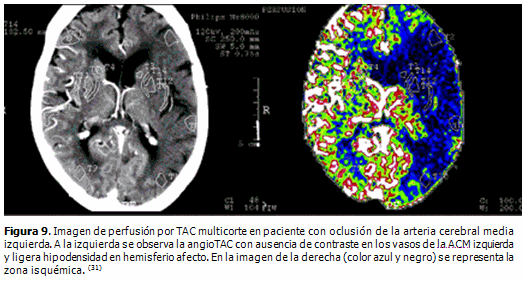
Con los equipos de TAC multicortes, se realizan estudios multimodales, angioTAC y perfusión, técnicas que requieren del uso de contraste yodado (Figura 9). Con las reconstrucciones tridimensionales de los vasos intra y extracraneales se puede definir la arteria ocluida de forma no invasiva.
La perfusión evalúa el flujo sanguíneo tisular cerebral por el paso del contraste yodado a lo largo de los pequeños vasos cerebrales. Ello permite medir varios parámetros [(tiempo que toma el bolo de contraste en alcanzar el valor máximo (TTP, siglas en inglés de Time To Peak), volumen sanguíneo cerebral relativo (rVSC) y flujo sanguíneo cerebral relativo (rFSC)] en el área isquémica y compararlas con los valores del hemisferio contralateral.
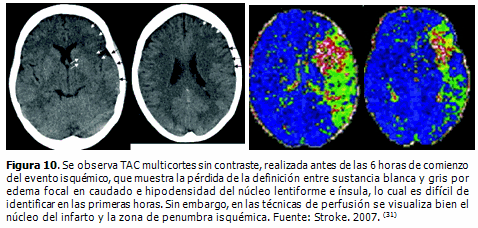
En los diferentes estudios revisados, se demuestra que la perfusión por TAC es una de las alternativas imaginológicas para identificar el núcleo del infarto y la zona de penumbra isquémica (Figura 10). La viabilidad del parénquima cerebral depende del flujo sanguíneo cerebral, la evaluación de la perfusión cerebral es importante para la selección de los pacientes que serán trombolizados. El mapa cuantitativo de FSC indica la severidad y el grado de reversibilidad del daño neuronal, pudiendo ser usado como predictor del tejido cerebral que puede ser recuperado con la reperfusión. (28-31)
Resonancia magnética por difusión
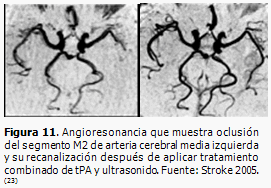
La RM permite localizar la oclusión del vaso a través de imágenes tridimensionales de los vasos intracraneales (angioRM). (Figura 11).
Las imágenes de resonancia magnética por difusión (RMD) se basan en la difusión del agua en el tejido cerebral. Al medir la autodifusión del agua, esta se utiliza en el estudio de enfermedades que llevan implícito el acumulo de agua regional. (32) Esta secuencia es más sensible a la isquemia cerebral precoz que las secuencias de resonancia convencionales (T2, FLAIR1).
La imagen de difusión es sensible al movimiento microscópico de los protones del agua. Es importante señalar que en los tejidos biológicos no existe una difusión libre, debido a las barreras que forman las membranas, los organelos celulares y las macromoléculas que contiene el citosol. (32) Las interacciones químicas también se presentan como obstáculos a la difusión. Por tanto, la autodifusión de agua en los tejidos biológicos es referida como una difusión aparente.
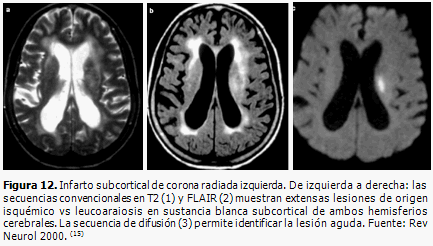
En la fase aguda de la isquemia cerebral hay una disminución de la difusión por reducción de la movilidad de los protones del agua intracelular, debido al edema citotóxico, (15, 32) lo cual se observa como una imagen hiperintensa, en las imágenes ponderadas en difusión (IPD), o hipointensas en imágenes por coeficiente de difusión aparente (CDA), desde los 2 ó 3 minutos de inicio del infarto hasta las primeras 96 horas. En la fase crónica de la isquemia cerebral se produce un aumento de la difusión, debido al aumento del agua extracelular, lo que se visualiza como una señal hipointensa. La disminución de la difusión es un indicador sensible de la isquemia cerebral precoz, en un momento en que las lesiones del tejido son potencialmente reversibles, y permite distinguir las áreas isquémicas agudas de los focos de leucoaraiosis (Figura 12).
Durante la fase aguda de los infartos subcorticales, el diagnóstico mediante TAC o con técnicas convencionales de RM se dificulta debido a la limitada sensibilidad en la detección de lesiones isquémicas agudas de pequeño tamaño, y a que la baja especificidad de dichas técnicas impide diferenciar de forma óptima entre lesiones de naturaleza aguda y crónica. (15)
Rovira demostró en su estudio que la secuencia de difusión por resonancia magnética tiene una elevada sensibilidad y especificidad en la detección precoz de lesiones isquémicas agudas. Además, permite visualizar diferencias entre lesiones agudas y crónicas, incluso, en fosa posterior; se han detectado infartos en humanos a las 2-3 horas después del evento agudo. Se plantea que la difusión continúa disminuyendo hasta el 4to día y se normaliza entre el 5to y 15to días, para aumentar luego progresivamente. (15) La normalización y posterior aumento de la difusión refleja la aparición paulatina del edema vasogénico y de necrosis, lo que aumenta la concentración de agua extracelular y, por tanto, facilita el movimiento térmico molecular. Es en este período que se hace visible en T2 y FLAIR.
Perfusión por resonancia magnética
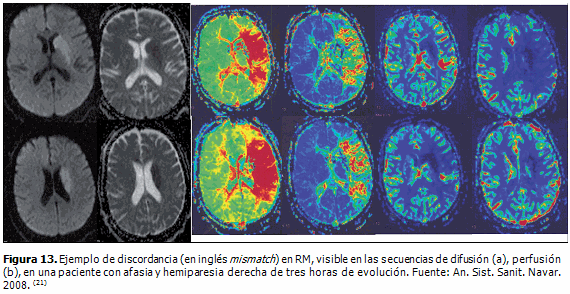
La RM por perfusión (RMP) mide el flujo, el volumen y el tiempo en que la sangre irriga el parénquima cerebral total o regional. Tiene una alta sensibilidad y especificidad en la detección temprana de la isquemia cerebral. Se basa en los cambios inducidos por la susceptibilidad magnética intravascular de moléculas paramagnéticas, ya sean administradas, extrínsecas, como el gadolinio (Gd), o intrínsecas, como la deoxihemoglobina. Esta técnica demuestra las zonas isquémicas como áreas con un flujo sanguíneo cerebral regional (rFSC) y un volumen sanguíneo cerebral regional (rVSC) disminuidos, así como un incremento en el tiempo medio de tránsito de la sangre a través del tejido afecto. (21) (Figura 13)
Se plantea teóricamente que los ATI (ataques transitorios de isquemia) producen alteraciones en las imágenes por perfusión, pero no en las imágenes por difusión.
Tomografía por emisión de positrones
La tomografía por emisión de positrones (PET) es una técnica de Medicina Nuclear. Utiliza moléculas marcadas con isótopos radioactivos, administrados a pacientes por vía intravenosa o inhalatoria para su posterior detección. Los isótopos utilizados en PET son emisores de positrones. Para el estudio del infarto cerebral, se utiliza la medición del flujo sanguíneo cerebral, la fracción de extracción de oxígeno, y el metabolismo del oxígeno y de la glucosa. (33, 34)
La PET muestra las alteraciones neuroquímicas desde el comienzo mismo de la instauración del infarto agudo, incluso en un periodo en el que el organismo no ha consumido los mecanismos fisiológicos compensatorios, mostrando en cada momento patrones hemodinámicos y metabólicos relacionados con el tiempo transcurrido y la severidad de la oclusión. Cuando se ocluye una arteria, al inicio, la reserva hemodinámica provoca vasodilatación en pocos minutos, durante la cual, la PET mostrará un rFSC y un consumo de oxígeno cerebral regional (rCO2C) aún normales. Si la presión de perfusión disminuye por debajo de los valores en los cuales la vasodilatación puede compensar y la autorregulación mantenerse (cerca de 60 mmHg), la extracción sanguínea de oxígeno aumenta de sus valores normales (30 - 40%) a 90 y 100 %; así, aunque el flujo sanguíneo haya disminuido, no ocurre hipoxia tisular, ya que la fracción de extracción de oxígeno (FEO2) ha aumentado para mantener la concentración normal de oxígeno tisular. En esta fase, llamada “perfusión mísera-oligohemia”, la PET muestra un rFSC reducido, una FEO2 aumentada y un rCO2C aún normal. (33, 34)
Cuando el flujo sanguíneo disminuye aún más, por debajo del punto crítico, en el cual la fracción de extracción de oxígeno (FEO2) no puede compensar este déficit, la entrega de oxígeno también disminuye y en la PET se observarán los signos característicos del infarto cerebral: disminución del rFSC (menor de 12/100g/min) y del rCO2C (1,5 ml/100g/min; valor normal 5ml/100g/ min), con un mayor aumento de la FEO2. Después de esta fase, el rCO2C continuará disminuyendo, hasta producirse un daño irreversible en el área central del infarto. (33, 34)
En las horas siguientes, si se recanaliza la arteria ocluida, la PET mostrará una zona de hiperperfusión, con elevación del rCO2C, que evitará que la zona de penumbra se transforme en infarto. En este caso la PET también servirá para evaluar la efectividad del tratamiento trombolítico y el restablecimiento de las funciones bioquímicas del tejido que se encontraba en penumbra isquémica. (34)
La perfusión de lujo es un hallazgo en el tejido necrótico, que comienza entre el 2do y 3er día y dura por varias semanas. Durante esta fase (infarto subagudo), el FSC se incrementa progresivamente y frecuentemente alcanza valores normales, o por encima de estos alrededor del 8vo al 12vo día, lo que indica reperfusión que ya no es útil en un tejido dañado irreversiblemente, reflejando quizás neovascularización con anormal autorregulación. (34)
Tractografía
Está basada en la forma tridimensional de la difusión del agua. La difusión libre es uniforme en todas las direcciones posibles, proceso denominado difusión isotrópica.
Cuando la difusión no es igual en todas las direcciones se le llama anisotrópica. (36)
La difusión anisotrópica en la sustancia blanca se origina por su organización en haces o tractos de fibras axonales mielinizadas; aunque el mecanismo exacto aún no se conoce del todo, se piensa que la barrera principal es la vaina de mielina de los axones. La isquemia cerebral interrumpe la mielina o la estructura del axón, reduciendo la anisotropia. (37, 38)
Las direcciones de la difusión anisotrópica se representan mediante mapas de colores. Por convención los tractos del eje “x” o comisurales aparecen en color rojo, por ejemplo: las fibras del cuerpo calloso cruzan de uno a otro hemisferio. Los tractos del eje “y” que representan fibras de conexión interlobular tienen tonalidad verde, por ejemplo: las vías ópticas que se proyectan desde la zona anterior a la posterior y los tractos del eje “z”, azules, estos son los haces córticoespinales descendentes que van desde la corteza hasta una porción de la médula espinal. (36-38)
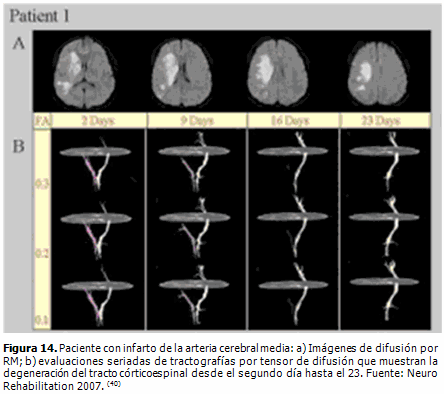
Varios han sido los trabajos en los que se demuestra que la tractografía con tensor de difusión es útil en el diagnóstico del infarto cerebral, ya que permite visualizar la velocidad de degeneración de los tractos dañados, así como las vías afectadas con la isquemia (Figura 14). (39, 40)
Espectroscopia
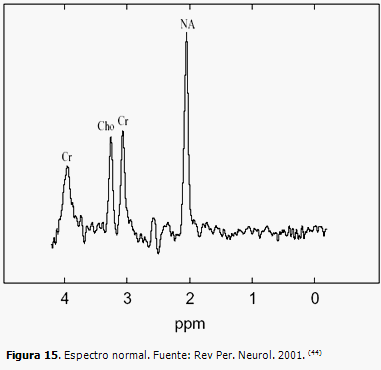
La espectroscopía por resonancia magnética (ERM) es considerada un método de imágenes moleculares. (41) Permite medir metabolitos cerebrales in vivo, por lo que entrega información bioquímica no invasiva de los tejidos (Figura 15). La concentración de metabolitos es diferente en la sustancia gris y la sustancia blanca, y varía de acuerdo a la edad del paciente. Cada molécula tiene su propio espectro. Sin embargo, a la hora de interpretar las imágenes es necesario cumplir los requisitos necesarios para no cometer errores. Estos estudios se realizan en resonadores de alto campo, mayor de 1,5 T; mientras mayor sea el campo magnético, mejor se diferenciarán las señales del espectro, pues tienen mayor resolución espacial. (42, 43)
Espectroscopia en el infarto cerebral agudo
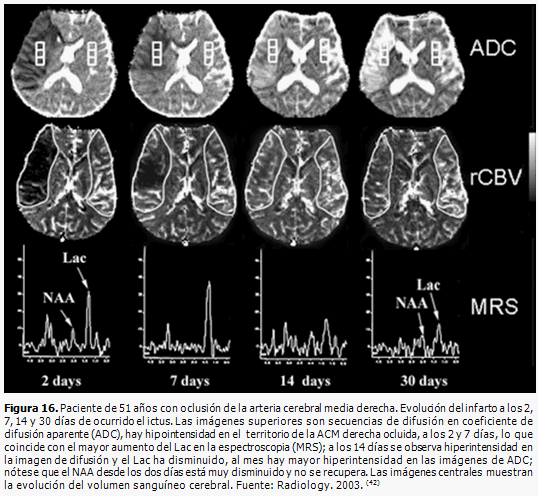
Durante el ictus isquémico el metabolismo anaeróbico de la glucosa aumenta la producción de ácido láctico (Lac). En la ERM, el patrón espectral en la isquemia aguda se caracteriza por el aumento inmediato del ácido láctico y disminución (que puede demorar horas o días) de la intensidad de la punta del N-acetil aspartato (NAA), que refleja el grado de lesión neuronal y posible recuperación funcional. La disminución de la relación N-acetil aspartato/Colina (NAA/Cho) se relaciona con infartos de mayor volumen y con un mal pronóstico neurológico al día 1 y 30. (Figura 16) (42, 45)
La leucoaraiosis que se encuentra en pacientes mayores de 60 años y en hipertensos, se visualiza como lesiones hiperintensas en la ponderación T2 de la RM; esta es un diagnóstico diferencial frente a infartos subcorticales múltiples. En la ERM los cambios relacionados con la leucoaraiosis muestran solamente elevación de la colina. (43)
CONCLUSIONES
Los cambios bioquímicos que llevan a neurotoxicidad e inflamación del tejido cerebral isquémico, han sido utilizados como marcadores biológicos, y su dosificación en sangre ha permitido su correlación con hallazgos neuroimginológicos. Estos estudios son de gran relevancia en el diagnóstico precoz, evolución y aparición de posibles complicaciones de la ECV isquémica, pues permiten valorar la eficacia de las intervenciones terapéuticas. La neuroimaginología es la forma no invasiva de visualizar algunos cambios bioquímicos que se producen durante la isquemia cerebral in vivo. Este trabajo ha mostrado que los hallazgos neuroimaginológicos están vinculados estrechamente con la neurobioquímica, y de cierta forma, se ha demostrado la importancia de conocer e interrelacionar ambas ciencias.
...................................................................................................................................................
1 Fluid attenuated inversion recovery. en español recuperación atenuada por inversión de fluido.