INTRODUCCIÓN
En el año 2016 el ictus fue la segunda causa de muerte a nivel mundial, con 5,5 millones de fallecidos, 13,7 millones de casos nuevos y un total de 80,1 millones de casos prevalentes.(1,2) Del número total de ictus prevalentes en el mundo, el 84,4 % fue de causa isquémica; además, ocupa la segunda causa de discapacidad global.(1,2) Entre sus complicaciones sobresalen las infecciones, al incrementar el riesgo de morir en un 30 %.(3)
La neumonía constituye la infección más frecuente, y se relaciona con una alta morbilidad y mortalidad.(4,5) La frecuencia de la neumonía asociada al ictus (NAI) varía considerablemente en la literatura, con rangos de 1,4 % a 57 %.(5) Un estudio reciente identificó una frecuencia de 12,3 %.(6)
El grupo de consenso multidisciplinario Pneumonia In Stroke ConsEnSus (PISCES) define a la NAI como el espectro de neumonía que se desarrolla en los primeros siete días después del inicio del ictus en pacientes sin ventilación mecánica.(7)
Diferentes investigaciones han identificado varios factores de riesgo de NAI, entre ellos sobresalen: la edad avanzada, el sexo masculino, la gravedad del ictus medido mediante la puntuación de la National Institutes of Health Stroke Scale (NIHSS), la puntuación en la escala de Glasgow, la disfagia, la comorbilidad asociada, entre otros.(8,9,10) Sin embargo, las evidencias aportadas por estas investigaciones no han permitido realizar intervenciones médicas, ni tratamiento clínico con impacto significativo en la prevención de la NAI, debido a algunas limitaciones, tales como: pequeños tamaños de las muestras, diferentes fuentes de la población, empleo de criterios diagnósticos heterogéneos, uso de diseños diversos en los estudios;(8,9,10) por otra parte, no incluyen parámetros inmunonutricionales que ayuden a mejorar la estimación de riesgo, todo lo cual sugiere la necesidad de realizar nuevos estudios prospectivos.
En Cuba no se han realizado investigaciones a gran escala con el fin de identificar los factores asociados con el desarrollo de la NAI, aspecto al cual este estudio pretende contribuir mediante el siguiente objetivo: identificar los factores de riesgo para el desarrollo de la neumonía asociada al ictus isquémico.
MÉTODOS
Se realizó un estudio observacional analítico, de cohorte prospectiva, en pacientes con ictus isquémico atendidos en los servicios de Medicina Interna, Neurología, Ictus, Terapia Clínica y Terapia Intermedia, del Hospital General Provincial Universitario Carlos Manuel de Céspedes, del municipio de Bayamo, provincia de Granma, desde el 1ro. de enero de 2015 hasta el 31 de julio de 2019.
Fueron incluidos todos los pacientes de 18 años o más, hospitalizados con diagnóstico de ictus isquémico según los criterios de la American Heart Association/ American Stroke Association;(11) con una puntuación en la escala de Glasgow mayor de 9 puntos, en los cuales no se constataron elementos de incubación, ni de infección respiratoria al momento del ingreso. Se excluyeron las gestantes, pacientes portadores del VIH o sida definido, paciente con el ictus de más de 48 horas evolución antes de su ingreso hospitalaria, disfagia preexistente, antecedente de enfermedades hematológicas malignas o hepáticas (hepatopatías agudas y crónicas, así como la cirrosis hepática) y antecedente de neoplasias.
Como criterios de neumonía asociada al ictus, se consideraron los propuestos por el grupo de consenso PISCES, basados en criterios clínicos y de imagen;(7) se incluyó, además, el diagnóstico microbiológico. Los criterios se detallan a continuación:
I-Criterios clínicos diagnósticos: los que se presentan después de las primeras 48 horas, al menos uno de los tres siguientes: fiebre > 38 grados centígrados sin otra causa reconocida; leucocitosis > 12,0 x 109/L o leucopenia < 4,0 x 109/L; adultos ≥ 70 años con alteración del estado mental sin otra causa reconocida, incluyendo específicamente el deterioro neurológico. Más al menos dos de los siguientes criterios: aparición de un nuevo esputo purulento, o cambio en sus características (color, olor, cantidad y consistencia) en un período de 24 horas, incremento de las secreciones respiratorias o en la necesidad de aspiraciones; nuevo episodio de tos, disnea o taquipnea (frecuencia respiratoria > 25/min); auscultación sugestiva (crepitantes, subcrepitantes y sibilantes); deterioro del intercambio gaseoso (desaturación de oxígeno (O2) [ejemplo, presión arterial de oxígeno/fracción inspirada de oxígeno (PaO2/FiO2) ≤ 240] o aumento de las demandas de O2).
II-Criterios de imagen: ≥ dos radiografías de tórax seriadas con al menos uno de los elementos siguientes: infiltración, consolidación o cavitación nueva o progresiva y persistente. En pacientes sin enfermedad cardiaca o pulmonar, una radiografía de tórax fue suficiente. Cuando la radiografía de tórax inicial fue normal, se realizó otra entre el segundo y séptimo día.
III-Criterios microbiológicos diagnósticos: cultivo positivo no cuantitativo del esputo; microorganismo aislado en dos o más hemocultivos positivos con idéntica sensibilidad al encontrado en secreciones y sin otra fuente de infección probable.
El tamaño de la muestra para el estudio se determinó mediante el programa estadístico EPIDAT 4.2. Para su estimación se consideraron los siguientes parámetros: nivel de confianza al 95 %, poder del estudio al 80 %, riesgo en expuestos 55,0 %, riesgo en no expuestos 40,0 %, riesgo relativo a detectar 1,3. La prevalencia de la enfermedad fue estimada según la literatura, en este caso, 14,0 %. Con estas características se calculó una muestra mínima de 715 pacientes, y se decidió investigar 725 pacientes.
Variable dependiente: neumonía asociada al ictus isquémico.
Variables independientes: edad (años cumplidos), sexo masculino; fumador activo; alcoholismo; antecedentes de enfermedad pulmonar obstructiva crónica (EPOC), diabetes mellitus (DM), hipertensión arterial (HTA), cardiopatía isquémica crónica (CIC), fibrilación atrial (FA), insuficiencia cardiaca, ictus previo (IP), disfagia neurogénica al ingreso. Todas fueron operacionalizadas como variables cualitativas nominales dicotómicas (0) ausentes y (1) presentes. Puntuación en la escala de NIHSS al ingreso (cuantitativa), la extensión y topografía del infarto cerebral según la clasificación de Oxfordshire Community Stroke Project.(12) El tipo de microorganismo se consideró como cualitativa nominal dicotómica: (0) ausencia y (1) presencia de determinados gérmenes. Marcadores biológicos (cuantitativas): las cifras de hemoglobina (Hb) dado en g/L, conteo de leucocitos x109/L, conteo de linfocitos (%), conteo global de linfocitos (CGL) mm3, conteo de plaquetas x109/l, cifras de alanina aminotransferasa (ALT o TGP) dado en UI, aspartato aminotransferasa (AST o TGO) dado en UI, colesterol en mmol/L, albúmina sérica en g/L, proteínas totales en g/L, glucemia en mmol/L, creatinina en μmol/L, urea en mmol/L.
El análisis estadístico comenzó por la caracterización global de la muestra con una descripción de todas las variables. Para las cualitativas se determinaron las frecuencias absolutas y relativas (porcentajes) de las distintas categorías. Para las cuantitativas se obtuvieron las medias, medianas y desviaciones estándar, así como los valores máximos y mínimos de cada distribución.
Para la comparación entre los pacientes con NAI y sin NAI se calculó el Ji cuadrado de Pearson (para las variables cualitativas) y la prueba t de Student para las variables cuantitativas, siempre que la distribución de esta de forma normal; o la U de Mann Whitney para aquellas variables cuantitativas con distribución no normal. En la identificación de los factores de riesgo se empleó una estrategia univariada basada en la estimación de los porcentajes de enfermos con NAI, la tasa de incidencia de la NAI tanto en el grupo de expuestos como en los no expuestos, y posteriormente la razón entre incidencias o riesgos relativos (RR) de adquirir NAI; se obtuvieron estimaciones puntuales y por intervalo de confianza (del 95 %) de los RR. Para cada variable se probó la hipótesis de que el RR poblacional fuese realmente igual o mayor de 1,3 con un nivel de significación menor de 0,05.
La estrategia multivariada se basó primeramente en el ajuste de un modelo de regresión logística binario, primero mediante el método "introducción" (evaluando posible interacción entre las variables) con todas aquellas que constituyeron factores predictores de la NAI en el análisis univariado; y luego mediante el método “paso a paso hacia delante” (forward stepwise). El ajuste de la función de regresión logística se realizó por el método de máxima verosimilitud. Se aplicó también el estadístico de bondad de ajuste Ji cuadrado de Hosmer y Lemeshow.
Este proceso se realizó con el algoritmo incluido en el paquete estadístico SPSS en su versión 25.0 para Windows. Antes de ser incluidos en el estudio se solicitó a cada paciente, o en su defecto (en caso de deterioro importante de nivel de conciencia o afasia severa), al familiar, su consentimiento informado verbal y escrito. El estudio fue aprobado por el Consejo Científico y Comité de Ética del Hospital.
RESULTADOS
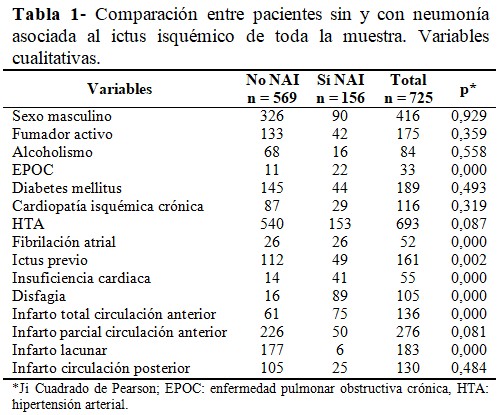
Se compraron las variables cualitativas de ambos grupos de pacientes con relación al desarrollo de la NAI, las diferencias más significativas fueron respecto al antecedente de EPOC, fibrilación atrial, insuficiencia cardiaca, disfagia y el infarto total de la circulación anterior (p = 0,00). (Tabla 1).
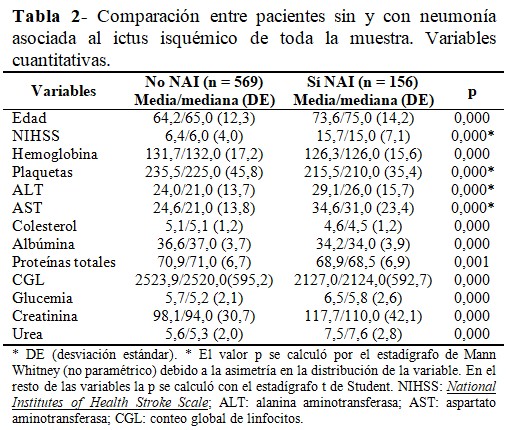
Al comparar las variables cuantitativas se observó diferencia significativa en todas ellas. Se destacaron por su contribución desde el punto de vista etiopatogénico: la edad, la puntuación en la escala de NIHSS, las cifras de albúmina, colesterol, CGL; además de la urea, creatinina, ALT y AST como expresión de las manifestaciones fisiopatológicas sistémicas del ictus isquémico. (Tabla 2).
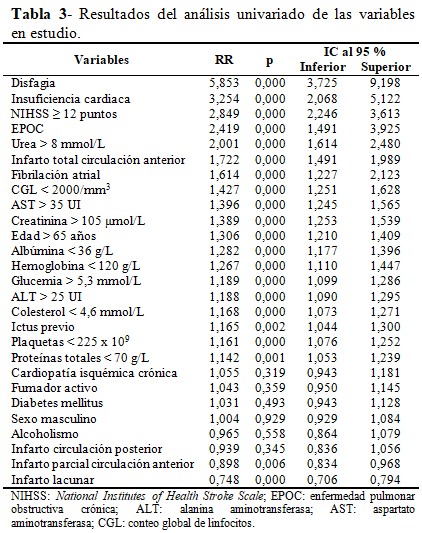
El análisis univariado mostró la relación entre las variables y la probabilidad de desarrollo de la NAI. Del total de variables estudiadas, solo 11 se relacionaron con el riesgo de desarrollar NAI al alcanzar un RR ≥ de 1,3. Los factores más importantes fueron la disfagia, la insuficiencia cardiaca y NIHSS ≥ 12 puntos. (Tabla 3).
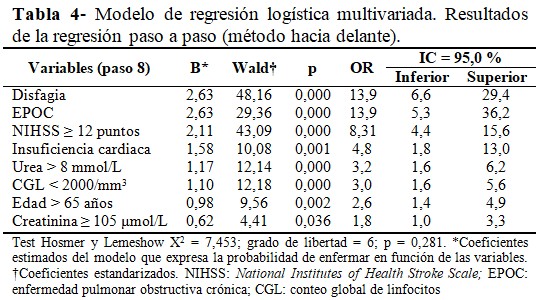
El modelo de regresión logística con todas las variables que constituyeron factor riesgo en el análisis estadístico univariado, mostró que la variable de mayor relación independiente con el desarrollo de la NAI fue la disfagia (OR = 13,9; IC 95 % = 6,6 - 29,4; p = 0,000); seguido del antecedente de EPOC (OR = 13,9; IC 95 % = 5,3 - 36,2; p = 0,000); y una puntuación en la escala de NIHSS ≥ 12 puntos (OR = 8,31; IC 95 % = 4,4 - 15,6; p = 0,000). (Tabla 4).
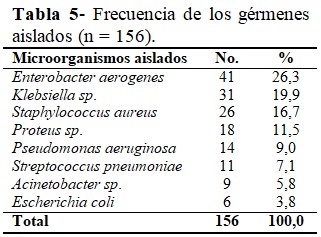
Los gérmenes aislados con mayor frecuencia fueron el Enterobacter aerogenes (26,3 %) y la Klebsiella sp., (19,9 %). (Tabla 5).
Con relación a los criterios clínicos cumplidos para la NAI, el 89,1 % presentó alteración leucocitaria, seguido de fiebre > 38℃ sin otra causa reconocida, presente en el 88,5 %. (Tabla 6).
DISCUSIÓN
Los resultados obtenidos en la actual investigación, en particular los relacionados con el modelo de regresión logística, muestran el principio de parsimonia no solo por reducir el número de variables estudiadas a ocho factores, sino también porque permite hacer una interpretación armónica desde el punto de vista etiopatogénico de la NAI y de la repercusión fisiopatológica sistémica del infarto cerebral sobre varios sistemas del organismo.
La disfagia tiene un papel patogénico importante en el desarrollo de la NAI, y su influencia como factor de riesgo se registra de manera constante, con una fuerte asociación constada por diferentes estudios,(8,9,10,13,14,15,16) las probabilidades (ORs) oscilan entre 1,8 y 15,5.(16) En un estudio de revisión sistemática y meta-análisis realizado por Wästfelt y colaboradores,(9) esta variable alcanzó un OR global de 3,5 (IC 95 % = 2,6 - 4,6; p = < 0,001). En otro con diseño similar, Yuan y colaboradores(15) también identificaron una fuerte asociación (OR = 7,5; IC 95 % = 2,6 - 21,6; p = 0,0002).
Además del agotamiento de la sustancia P, neurotransmisor relacionado con el reflejo de la tos y deglución, la disfagia post-ictus está explicada por los daños en las áreas cerebrales implicadas en la activación voluntaria, la supervisión y modulación del proceso de la deglución localizados a nivel de la corteza motora primaria, la corteza somatosensorial, la ínsula, la circunvolución frontal inferior, corteza premotora y el área motora suplementaria, entre otras; así como en las estructuras subcorticales, como los ganglios basales, el tálamo y el cerebelo.(17,18)
Existe una relación significativa entre la EPOC y el desarrollo de la NAI.(13,14,15,16,19) Al igual que en la presente investigación, varios autores han obtenido resultados ratificando esta relación; tal es el caso del estudio multicéntrico con 8251 pacientes que realizó Finlayson y colaboradores,(8) en el cual la EPOC es uno de los factores asociados al desarrollo de la NAI (OR = 1,3; IC 95 % = 1,0 - 1,7; p = < 0,01). De igual manera, Ji y colaboradores(14) obtuvieron un OR de 1,6 (IC 95 % = 1,0 - 2,5; p = 0,02), lo cual lo ratifica como factor relacionado con el desarrollo de la NAI.
Los pacientes con EPOC tienen mecanismos de defensa local y una respuesta inmune en el ámbito pulmonar alterada; se reduce la elasticidad alveolar, acompañada del deterioro del aclaramiento mucociliar, además de que la superficie mucosa del pulmón de estos pacientes se encuentra expuesta constantemente a microrganismos patógenos, con potencial para causar neumonía en el huésped susceptible.(19,20)
Huang y colaboradores(21) para una puntuación de NIHSS entre 5 a 15 obtuvo un OR de 5,4; y para una puntuación NIHSS ≥ 16 el riesgo se incrementó (OR=10,4). Kömürcü y colaboradores(22) plantean que los cambios dinámicos en las plaquetas, neutrófilos, recuento de linfocitos, en el período temprano después el tratamiento con rtPA/o trombectomía puede estar relacionado con la puntuación de NIHSS, lo cual determina el grado de daño neurológico.
Existe suficiente evidencia científica que demuestra que la inmunosupresión inducida por el ictus depende también de la gravedad medida clínicamente mediante la escala de NIHSS, extensión y ubicación del infarto cerebral.(13,23,24) La extensión del infarto tiene como resultado una reducción del tamaño del bazo y de la celularidad esplénica debido a alteraciones en la regulación de los sistemas simpático y parasimpático. Por otra parte, tanto los infartos cerebrales extensos, como el ictus grave, se asocian con una mayor producción de interleuquina 10 (IL-10), una disminución en la relación linfocitos Th1/Th2, linfocitopenia y una función deteriorada de los monocitos; de manera que se ha llegado a postular que esta inmunosupresión inducida por el ictus puede constituir una respuesta adaptativa del cerebro al daño cerebral agudo.(13,23,24)
Liu y colaboradores,(25) en su estudio experimental, examinaron tanto los órganos linfoides como los linfocitos. Los pacientes en la fase aguda del ictus isquémico (< 24 h) mostraron una marcada atrofia del bazo, comprobado por resonancia magnética, y presentaron, además, linfopenia.(25,26)
Los linfocitos T y B son los principales actores de la inmunidad adquirida y se encuentran principalmente en la sangre, el bazo y los ganglios linfáticos. Tras el ictus isquémico la cuantía de linfocitos T y B en periferia disminuye, además de constatarse marcada atrofia del bazo y ganglios linfáticos.(22) Tal como se ha demostrado, el efecto apoctótico de la liberación de catecolaminas y glucocorticoides debido a la activación del sistema nerviosos central (SNS) y desregulación del eje hipotálamo-hipofisario- suprarrenal (EHHS), puede explicar la linfopenia observada después del ictus. De hecho, se ha podido confirmar que la concentración de catecolaminas en plasma se correlaciona con la intensidad de inmunosupresión tras el ictus en humanos.(13,23,27)
La elevación de la cifra de creatinina es explicada por la respuesta fisiopatológica sistémica al ictus isquémico. La hiperactivación autonómica inducida por al ictus isquémico aumenta la actividad simpática y la inflamación sistémica, alterando la homeostasis renal.(26,28) Los pacientes con ictus isquémico pueden desarrollar una lesión renal aguda, definida por disminución del ritmo diurético o aumento de la creatinina sérica dentro de las primeras 48 horas.(29,30) En un meta-análisis realizado por Huang y colaboradores(29) se identificó que la incidencia de la lesión renal aguda tras el ictus isquémico es del 12 % (IC 95 % = 9 % -16%, I2 = 99,7 %, p < 0,001), aunque puede oscilar entre el 0,8 % y el 26,6 %. Dicho estudio demostró que los pacientes con más altas puntuaciones en la escala de NIHSS al ingreso (OR/RR 1,0; IC 95 % = 1,0 - 1,1; I2 = 89,6 %, p < 0,001), están asociados con un riesgo elevado de lesión renal aguda.
El presente estudio logró identificar con claridad los factores de riesgos relacionados con el desarrollo de la NAI para un contexto asistencial determinado, además de incorporar nuevos factores independientes que permiten mejorar la estimación del riesgo de esta complicación, por lo cual se convierte en una herramienta útil para la estratificación de este grupo de pacientes y elaborar estrategias de prevención.
Conflicto de interés:
Los autores declaran que no existen plagios, conflictos de interés ni conflictos éticos.
Contribución de los autores:
Conceptualización: Alexis Suárez Quesada
Curación de datos: Alexis Suárez Quesada, Alexis Álvarez Aliaga, Andrés Quesada Vázquez, Julia Matilde Pupo Jiménez
Análisis formal: Alexis Suárez Quesada, Alexis Álvarez Aliaga, Andrés Quesada Vázquez, Julia Matilde Pupo Jiménez
Investigación: Alexis Suárez Quesada, Alexis Álvarez Aliaga, Andrés Quesada Vázquez, Julia Matilde Pupo Jiménez
Metodología: Alexis Suárez Quesada, Andrés Quesada Vázquez, Alexis Álvarez Aliaga
Validación: Alexis Álvarez Aliaga, Andrés Quesada Vázquez
Redacción – borrador original: Alexis Suárez Quesada, Julia Matilde Pupo Jiménez
Redacción – revisión y edición: Alexis Álvarez Aliaga, Andrés Quesada Vázquez
Financiación:
Hospital General Universitario Carlos Manuel de Céspedes (Bayamo, Granma)