INTRODUCCIÓN
El infarto cerebral es el conjunto de manifestaciones que aparecen como consecuencia de la alteración cualitativa o cuantitativa del aporte circulatorio a una determinada región encefálica, lo cual determina un déficit neurológico focal, expresión de necrosis hística.(1)
A pesar de los avances en el manejo del ictus isquémico, alcanzados en las últimas décadas, y los beneficios reportados por la trombolisis intravascular, las cifras absolutas de personas que mueren por infarto cerebral y viven con las consecuencias de este, se incrementan anualmente.
En promedio, cada tres minutos y 45 segundos, alguien muere debido a un ictus. Se estima que para el año 2030 el número de muertes por accidente cerebrovascular (ACV) podría aumentar en aproximadamente un 50 % en comparación con el año 2012.(2) En Cuba, la enfermedad cerebrovascular ocupa desde hace más de cuatro décadas la tercera posición como causa directa de muerte, la primera causa de discapacidad crónica del adulto y la segunda de demencia.(3,4)
Por lo tanto, el pronóstico global tras un ACV isquémico continúa siendo desfavorable, más aún en aquellas oclusiones de grandes vasos; así, el infarto total de circulación anterior es responsable de tres quintas partes de los pacientes que se convierten en dependientes, y de más de nueve décimas de las muertes atribuidas al infarto cerebral.(5)
Los factores que determinan los efectos de la oclusión arterial sobre el tejido encefálico incluyen la extensión del infarto y su magnitud total, y otros elementos modificadores de la isquemia, como la velocidad de oclusión, el nivel de la presión arterial, la hipoxia y la hipercapnia, y las alteraciones en la viscosidad y la osmolaridad de la sangre, así como las anomalías de la distribución vascular y la existencia de oclusiones vasculares previas.(6)
El pronóstico de los pacientes con infarto cerebral, analizado desde puntos de vista diferentes, y a la vez complementarios, como serían el pronóstico vital, clínico y funcional, va a depender, por tanto, de los factores atenuantes o contribuyentes de la necrobiosis cerebral de origen isquémico, y otras cualidades clínicas de cada individuo que lo hacen más o menos susceptible a una evolución tórpida.
En relación con las variables clínicas y demográficas, suele hacerse alusión sobre factores no modificables como la edad, sexo, color de la piel y enfermedades crónicas ya presentes al momento del ingreso, que constituyen caracteres prácticamente invariables, adjuntos a un vaticinio intrínsecamente determinado, y con poca o ninguna posibilidad de ser modificado.
Además de las variables clínicas y demográficas, el pronóstico global de los pacientes con infarto cerebral depende de una serie de factores relacionados con características intrínsecas de la lesión isquémica, que incluyen el volumen del infarto o territorio vascular afectado, el subtipo etiológico y la lateralización de este.
Aunque los factores que determinan el pronóstico del ictus son disímiles, y altamente variables entre los pacientes, lo que los hace impredecibles y difíciles de reproducir de un estudio a otro, las siguientes variables predictivas han sido utilizadas reiteradamente en diversos modelos pronósticos:(6,7,8,9) edad del paciente, sexo, comorbilidades al ingreso, presencia de síndrome metabólico, ictus recurrente, volumen del infarto, alteración de la conciencia, hipertermia, neumonía, insuficiencia cardíaca y alimentación nasogástrica, puntaje de la escala de Coma de Japón, Índice de Barthel (IB), escala de Rankin modificada (mRS), y Escala de Infartos Cerebrales de los Institutos Nacionales de los EE. UU. (NIHSS).
El comportamiento epidemiológico del infarto cerebral incrementa la necesidad de estudios encaminados a describir y caracterizar el pronóstico de los pacientes, y a establecer factores correlacionados con la evolución, resumidos en modelos que permitan dirigir acciones de tratamiento hacia dichos determinantes. Sin embargo, en la provincia Villa Clara, Cuba, no existen precedentes de estos estudios. Por ello, la presente investigación se realizó con el objetivo de describir los principales factores pronósticos, clínicos y epidemiológicos en pacientes con infarto cerebral total de circulación anterior, atendidos en un hospital de esta ciudad.
MÉTODOS
Se realizó un estudio descriptivo observacional, de diseño longitudinal, en pacientes adultos con diagnóstico de infarto cerebral total de circulación anterior (ITCA), ingresados en la Unidad de Ictus del servicio de Neurología del Hospital Provincial Arnaldo Milián Castro (HAMC), desde marzo de 2017 hasta marzo de 2018. Para establecer dicho diagnóstico se tomaron como referencia los criterios clínicos de extensión y localización señalados por el Oxfordshire Community Stroke Project,(10) posteriormente confirmados mediante tomografía axial computarizada (TAC) o resonancia magnética nuclear (RMN).
El universo estuvo constituido por 62 pacientes, y se incluyeron aquellos cuyos síntomas habían iniciado desde hacía menos de 72 horas, y habían otorgado el consentimiento informado para participar en el estudio. Otros criterios de inclusión tuvieron en cuenta la ausencia de: 1) accidente cerebrovascular isquémico vertebrobasilar, 2) ictus isquémico y/o hemorrágico previos, 3) puntuación en la mRS ≥ 3 puntos, 4) lesiones cerebrales estructurales confirmadas por los medios imageneológicos (tumor cerebral, abscesos cerebrales, hematoma intraparenquimatoso (HIP), hematomas subdurales, hidrocefalia). Finalmente, fueron incluidos 35 pacientes.
Se consideraron las siguientes variables independientes:
En relación con los parámetros demográficos y clínicos: edad, sexo, color de la piel, antecedentes patológicos personales (hipertensión arterial, diabetes mellitus, tabaquismo, alcoholismo, fibrilación auricular, cardiopatía isquémica, insuficiencia cardíaca, infarto del miocardio).
Los parámetros relacionados con la lesión isquémica incluyeron: volumen del infarto según TAC o RMN (arteria cerebral media-m1 o carótida interna-distal), lateralidad (izquierdo o derecho) y subtipos etiológicos según la clasificación del National Institute of Neurological and Communicative Disorders and Stroke (NINCDS) del año 1990 (aterotrombótico, cardioembólico, indeterminado).(11)
También se determinaron el promedio de frecuencia cardíaca, el promedio de presión arterial media y el tiempo transcurrido con una saturación de oxígeno menor de 90 % (T90) durante el sueño, mediante un registro continuo de ocho horas, realizado en las primeras 72 horas del ictus, a través de un dispositivo de poligrafía de tipo SOMNO medics GmbH. Am Sonnenstuhl 63-D-97236 Randersacker.
La variable pronóstico global fue la variable dependiente compleja. Para su definición se tomaron en cuenta las siguientes tres variables: pronóstico vital: (fallecido: sí/no); pronóstico clínico: muy grave (≥ 3 complicaciones y NISHHe≥20); grave (<2 complicaciones y NISHH<20); pronóstico funcional: bueno: IBe≥60 y mRSd≤3 a los tres meses del infarto, aceptable: IB=21-59 y mRS=4 a los tres meses del infarto, malo: IBd≤20 y mRS=5 a los 3 meses del infarto). Según esto, la variable fue clasificada en: favorable y no favorable. Los pacientes fallecidos fueron ubicados independientemente en el grupo pronóstico no favorable.
Se consideró favorable en pacientes que cumplieron al menos uno de los siguientes criterios: ≤2 complicaciones, NISHH<20, IB>20 y mRS≤4 a los tres meses del infarto; y no favorable en pacientes que cumplieron los siguientes cuatro criterios: ≥3 complicaciones, NISHH≥20, IB≥20, mRS=5 a los tres meses del infarto.
Los datos recolectados en este estudio se registraron en un libro de Microsoft Excel 2010, y posteriormente fueron procesados mediante el software SPSS versión 15.0. Los resultados fueron llevados a tablas y gráficos estadísticos, de frecuencias absolutas y porcentajes, así como la media y la desviación estándar, en el caso de variables medibles por una escala cuantitativa. Los datos categóricos o cualitativos se analizaron mediante la prueba Chi-cuadrado. Se determinó la significación exacta o por el método de Monte Carlo, cuando no se cumplió la premisa de la prueba de que menos del 25 % de las celdas tenían frecuencias esperadas menores que cinco. Para comparar las medias de una variable, correspondientes a dos grupos independientes, se utilizó la Prueba t de Student. Cuando falló el supuesto de la normalidad de los datos, se utilizó la prueba de Mann-Whitney. Extensivo para todos los test, se consideró el valor de la significación (p) correspondiente al estadígrafo de las pruebas de hipótesis usadas como:
Muy significativo: p menor que 0,01.
Significativo: p mayor o igual que 0,01 y menor que 0,05.
No significativo: p mayor o igual que 0,05.
La investigación fue aprobada por el Comité de Ética y el Consejo Científico del HAMC. Se obtuvo el consentimiento informado de participación de parte de los pacientes o representantes legales.
RESULTADOS
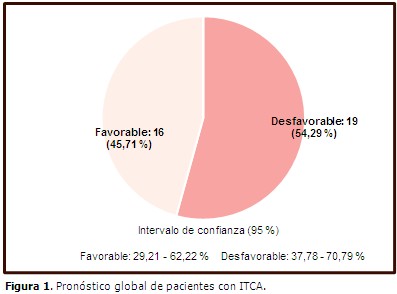
El 45,7 % (16/35) de los pacientes (N=35) presentó tres o más complicaciones; el 85,7 % (30/35) tuvo un déficit neurológico grave. De manera general, el 54,29 % de la serie (19/35) presentó un pronóstico global no favorable. (Figura 1).
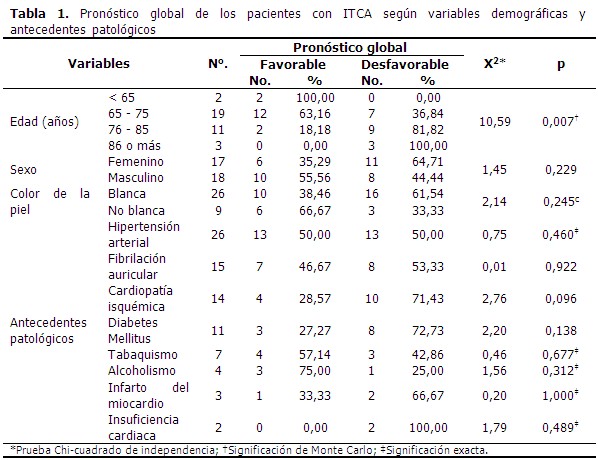
De las variables independientes analizadas, solo la diferencia en cuanto a edad se asoció significativamente con el pronóstico global (X2=10,59; p=0,007). (Tabla 1).
Un 81,82 % (9/11) de los pacientes de 75 años de edad y hasta los 85, evolucionó desfavorablemente; llegó al 100 % en los pacientes con 86 años o más. El porcentaje fue mucho menor en casos con pronóstico global no favorable del grupo de 65 a 75 años (36,84 %).
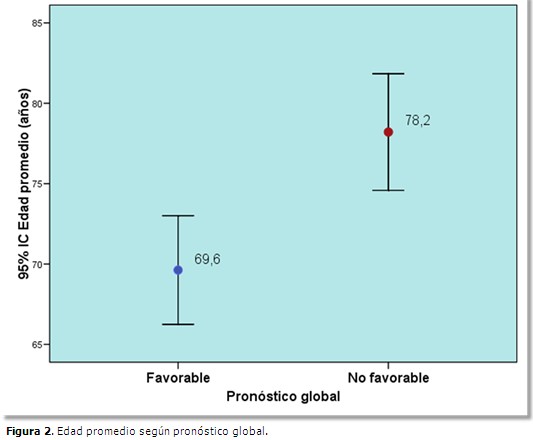
La edad media de los pacientes con pronóstico global no favorable fue de 78,2 años, y de 69,6 años en los de pronóstico favorable. (Figura 2).
El resto de las variables analizadas como sexo, color de la piel, y antecedentes patológicos personales, no se asociaron significativamente al pronóstico global de los pacientes con ITCA.
En cuanto al sexo, el 64,71 % (11/17) del total de mujeres estudiadas, en comparación con el 44,44 % (8/18) de los hombres, tuvieron una evolución no favorable (X2=1,45; p=0,229). En relación al color de la piel, el 61,54 % (16/26) de los de piel blanca evolucionaron desfavorablemente (X2=2,14; p=0,245), en comparación con el 33,33 % (3/9) de los pacientes de piel no blanca. De los 35 pacientes estudiados, 26 eran hipertensos, en 15 se constató el antecedente de fibrilación auricular, 14 padecían de cardiopatía isquémica, y 11 eran diabéticos. Sin llegar a establecerse una asociación significativa, entre los pacientes con antecedentes patológicos, fue más frecuente el pronóstico no favorable.
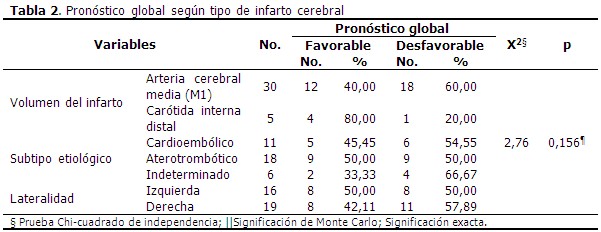
Igualmente, ninguno de los factores asociados a la lesión isquémica se relacionó significativamente con el pronóstico global de los pacientes (p>0,05). Entre los enfermos con infarto cerebral correspondiente al territorio M1 de la arteria cerebral media (ACM), el 60 % (18/30) evolucionó desfavorablemente, y el 20 % (1/5) de los que presentó un infarto carotídeo distal, tuvo un pronóstico global no favorable (X2=2,76; p=0,156). El 66,67 % y el 54,55 % de los pacientes con infarto cerebral indeterminado o cardioembólico, respectivamente, alcanzaron un pronóstico global no favorable, con solo el 50 % de los pacientes con infarto de etiología aterotrombótico en este grupo pronóstico. De los 16 pacientes con infarto cerebral del hemisferio cerebral derecho, el 57,89 % tuvo un pronóstico no favorable, mientras que el 50,0 % de los pacientes con infarto del hemisferio izquierdo evolucionaron de esta manera. (Tabla 2).
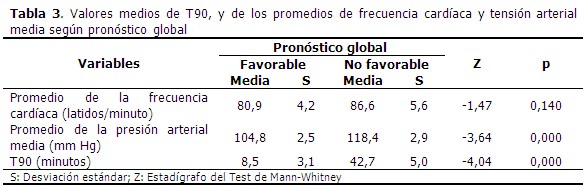
En cuanto a las variables obtenidas del registro polisomnográfico continuo durante ocho horas de sueño, solo la PAM y el T90 se asociaron significativamente al pronóstico de los pacientes. A pesar de que el promedio de la frecuencia cardíaca durante el sueño fue aproximadamente de 6 latidos/minuto más en el grupo de pacientes con pronóstico global no favorable, en comparación con aquellos que evolucionaron favorablemente; así, valores superiores de frecuencia cardíaca se asociaron a peor pronóstico, relación que no llegó a ser estadísticamente significativa (Z=-1,47; p=0,140). (Tabla 3).
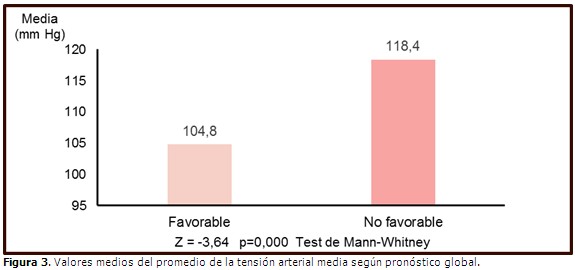
Paralelamente, los pacientes con mayores cifras de PAM y mayor tiempo con saturación de O2 menor que 90 % (T90) durante el sueño, sí tuvieron más probabilidad de presentar un pronóstico final desfavorable (p=0,000). La PAM media en los pacientes con resultados no favorables fue de 118,4 mmHg, y de 104,8 mmHg en los que presentaron un pronóstico favorable. (Figura 3).
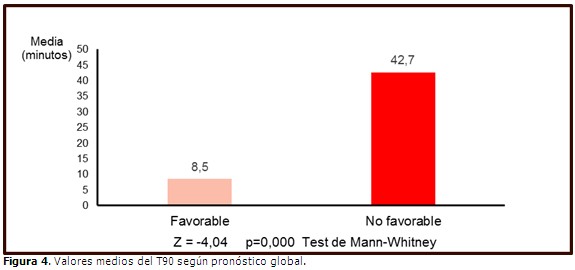
Las diferencias fueron mucho más pronunciadas con respecto al T90; el tiempo medio durante el cual los pacientes con pronóstico no favorable pasaron con desaturaciones de O2 por debajo del 90 %, fue de 42,7 minutos, mientras que en los de evolución favorable fue solo de 8,5 minutos. (Figura 4).
DISCUSIÓN
La posibilidad de estimar el pronóstico de los pacientes con ictus puede dotar de herramientas útiles en diversos planos a los profesionales implicados en su manejo. Estas herramientas facilitarían potencialmente la toma de decisiones y la planificación de estrategias terapéuticas, tanto dirigidas al tratamiento de emergencia, de soporte, como rehabilitador, lo que dotaría a médicos y familiares de mecanismos más certeros y eficaces, con resultados alentadores en cuanto a supervivencia, capacidad funcional y calidad de vida de los pacientes con infarto cerebral.
El pronóstico del ictus puede entenderse desde aristas diferentes, y a la vez complementarias, como sería el pronóstico vital, neurológico y funcional. Desde el punto de vista vital el ictus isquémico supone actualmente la tercera causa de muerte, y alrededor de un tercio de los pacientes fallecen o son dependientes al cabo de un mes.(12)
En el presente estudio, la mortalidad y discapacidad asociadas al ictus es superior a la informada por otras investigaciones, debido a que se estudiaron pacientes con ITCA, quienes en comparación con los ictus menores se asocian directamente con mayores tasas de mortalidad intrahospitalaria y a largo plazo, y un aumento de la discapacidad, dependencia funcional y de las complicaciones neurológicas y médicas. Según Koton y colaboradores,(7) las complicaciones son responsables de 1/3 de los factores que determinan el pronóstico final de un ictus. Además, alrededor del 10 % de los pacientes con infarto de ACM evolucionan a un infarto maligno, cuya historia natural dada por edema vasogénico, hipertensión endocraneana y desplazamiento de estructuras de la línea media, es catastrófica, e implica cifras de mortalidad de hasta un 80 %, con grandes tasas de discapacidad en los supervivientes.(13)
Zaidi y colaboradores(14) observaron en un análisis multivariante de factores predictores de evolución clínica en fase aguda del infarto cerebral, que el volumen de infarto se comporta como una variable predictora independiente del pronóstico clínico. Malhotra y colaboradoes(5) concluyen que los infartos por oclusión de grandes vasos son responsables de tres quintas partes de la dependencia y de más de nueve décimas de mortalidad después de un ictus isquémico agudo.
El análisis de las características clínicas y demográficas de la serie demuestra mayor tendencia a presentar un pronóstico global desfavorable entre los individuos mayores de 75 años de edad, del sexo femenino, color blanco de la piel, o en quienes presentan como antecedentes patológicos personales la insuficiencia cardíaca, la diabetes mellitus, la cardiopatía isquémica, el infarto del miocardio o la fibrilación auricular. Entre ellas, la edad resulta ser la única variable con un grado de asociación significativa al pronóstico global de los pacientes.
Los resultados son coincidentes con los obtenidos por varios artículos publicados, en los que una mayor edad, el sexo femenino(15) y las comorbilidades previas, donde destacan la diabetes mellitus y la hiperglicemia tanto aguda como crónica,(16,17) y distintos tipos de patologías cardíacas como la fibrilación auricular, la cardiopatía isquémica y la insuficiencia cardíaca están fuertemente asociadas con la mortalidad y el peor pronóstico funcional a los tres meses.(18,19)
El peor pronóstico atribuido a las mujeres es puesto de manifiesto en el estudio de Govindarajan y colaboradores,(20) quienes atribuyen dicho fenómeno a la edad media más alta encontrada en las mujeres con ACV isquémico y la mayor severidad de los infartos, además de las diferencias entre sexos en las percepciones y acceso al tratamiento ante los síntomas de ictus.
En relación a la edad, diferentes modelos predictivos a través de estudios de base poblacional han incluido la edad como un factor pronóstico importante. Ejemplo de ellos son el Ischemic Stroke Predictive Risk Score (iSCORE) y el Preadmission Comorbidities, Level of Consciousness, Age, and Neurologic Deficit Score (PLAN Score), que utilizan la edad como predictor de mortalidad a los 30 días y de una puntuación en la escala de Ranquin de 0-2 al alta.(12,21) También Chandra RV y colaboradores(22) han sugerido que el pronóstico clínico en pacientes mayores de 80 años sometidos a tratamiento endovascular es peor que en menores de 80, aun con rangos de recanalización y tiempos de isquemia similares.
Los motivos por los cuales la edad puede provocar diferencias en el pronóstico de los pacientes con ITCA están dados por el aumento de comorbilidades y la disminución asociada al envejecimiento de los procesos implicados en la neuroprotección, como la angiogénesis, la neuro-regeneración y la neuroplasticidad.
Resulta curioso que en la presente investigación los pacientes con infarto de ACM (M1) presentan mayor porcentaje de casos con pronóstico global no favorable que aquellos con infarto carotídeo distal, a pesar del mayor volumen de tejido infartado en este último, lo cual es contradictorio con los resultados publicados por otros autores, donde la severidad y, por tanto, el pronóstico de los pacientes con infarto cerebral es directamente proporcional al volumen de la lesión. Vogt G y colaboradores(23) publicaron que el volumen de la lesión isquémica es un predictor independiente de mortalidad y pronóstico funcional a los 90 días del ACV isquémico.
En esta serie, la edad media de los pacientes con infarto carotídeo distal es de 65 años, en comparación con una media de 78 años en los pacientes con infarto de ACM (M1), lo cual, como ya se había mencionado en el acápite anterior, se asocia con un mayor riesgo de comorbilidades y con la disminución de los procesos implicados en la neuroprotección. Se infiere que, a medida que la edad avanza, existe una mayor susceptibilidad a que el volumen del infarto sea capaz de impedir una buena recuperación.
En sintonía con estudios previos, como el de Yoo y colaboradores,(24) donde el umbral de 50 cc para el volumen del infarto, como punto de corte para definir buena evolución clínica, pierde valor drásticamente en pacientes octogenarios o mayores, quienes requerirán un volumen de infarto muy pequeño, inferior a 15 cc para volver a ser independientes.
Además de la edad, otros elementos que pueden influir en la inter-variabilidad en el pronóstico de pacientes con volúmenes de infarto diferente son la velocidad de crecimiento del core necrótico y la tolerancia isquémica, las que están sujetas a diversas condicionantes, como el estado de circulación colateral, la precondición isquémica, el estado de actividad metabólica y la capacidad de liberación de O2.
De forma congruente con otras investigaciones en cuanto a la relación entre el subtipo etiológico del ictus isquémico y el pronóstico global de los pacientes, el infarto cerebral cardioembólico se asocia con peores resultados a corto y a largo plazo. En este sentido, diversos elementos que caracterizan al infarto cardioembólico como la mayor incidencia de transformación hemorrágica, crisis convulsivas e infartos múltiples, además de la presencia de tasas más altas de complicaciones cardiovasculares durante la fase aguda del ictus, pudieran explicar el pronóstico no favorable en estos casos.
Joundi y colaboradores(25) publicaron que el infarto del miocardio, la insuficiencia cardíaca congestiva y la fibrilación auricular (FA) son predictores independientes de paro cardíaco después de un infarto cerebral. Asimismo, Xianying y colaboradores(26) plantearon que la FA parece ser un factor de riesgo independiente de mortalidad hospitalaria, y aumenta en 1,63 días la duración media de la estancia hospitalaria en pacientes que sufren un ictus isquémico. Según Burneo y colaboradores,(27) las crisis epilépticas tras el ictus isquémico se asocian con una mayor mortalidad, mayor estancia hospitalaria y mayores tasas de discapacidad.
En relación a la lateralidad, no es casual que en el grupo de pacientes con infarto del hemisferio derecho exista un mayor porcentaje de individuos con pronóstico global no favorable, con respecto a los del hemisferio izquierdo. Los motivos por los cuales se produce dicho fenómeno incluyen, en parte, la desregulación autonómica producto de los infartos del hemisferio derecho, especialmente con afectación de la ínsula. Coincidentemente, Yperzeele y colaboradores(28) demostraron que la disfunción autonómica cardíaca, representada por la reducción de la VFC o la sensibilidad alterada del barorreceptor, se asocia con la gravedad, las complicaciones tempranas y tardías, la dependencia y la mortalidad de pacientes con ACV isquémico.
Similares resultados publicaron Akıl y colaboradores,(29) quienes encontraron durante los primeros tres días posteriores al infarto del territorio de la ACM derecha, altos niveles plasmáticos de norepinefrina y epinefrina, y mayor densidad en el espectro de la banda de baja frecuencia en el análisis de la VFC según el dominio de frecuencia, lo que sugiere una disfunción autonómica cardiovascular con predominio de la actividad simpática.
Un estudio reciente en 20 pacientes con ACV derecho y 20 pacientes con ACV isquémico izquierdo, en los primeros seis meses después del evento agudo, demostró que los parámetros que reflejan el predominio parasimpático en el dominio del tiempo (RMSSD) y el análisis del dominio de frecuencia (HF) son mayores en el ictus del hemisferio izquierdo que en los del hemisferio derecho.(30)
La hiperactividad simpática causada por la lesión insular derecha pudiera conllevar a la desregulación cardiovascular, la aparición de cambios electrográficos, arritmias graves, e incluso, la muerte, luego de la isquemia cerebral. La exposición excesiva a las catecolaminas provoca la afluencia masiva de Ca a la fibra cardíaca, lo que desencadena la liberación de enzimas degradantes, que pueden dañar la red conductiva subendocárdica, y alterar la automaticidad cardíaca, la refractariedad y la repolarización, lo que finalmente ocasiona la aparición de cambios electrocardiográficos que incluyen inversión difusa de ondas T altas (ondas T cerebrales), aparición de ondas U prominentes en ausencia de anomalías electrolíticas, prolongación de los segmentos ST y QT y ensanchamiento del complejo,(31) así como la generación de arritmias cardíacas graves, taquiarritmias de origen auricular (taquicardia supraventricular, aleteo auricular/fibrilación) o ventricular (taquicardia ventricular/fibrilación y torsade de pointes).(32)
Además, se produce aumento de biomarcadores cardíacos, como la troponina, que se interpreta como un indicador de daño miocárdico por el desarrollo rápido de microinfartos subendocárdicos, degeneración miofibrilar o miocitólisis, también debido a la exposición excesiva a las catecolaminas sin evidencia angiográfica de una enfermedad arterial coronaria subyacente.(33)
Las cifras de PAM y la saturación adecuada de oxígeno en la sangre durante la fase aguda del ictus isquémico, constituyen dos factores pronósticos determinantes en el pronóstico global de los pacientes infartados. La relación entre la variabilidad en el control de la presión arterial y el pronóstico tras un ictus, se debe al papel que esta juega en el mantenimiento de la presión de perfusión cerebral y en el flujo sanguíneo regional.
Las cifras de tensión arterial sistólica/tensión arterial diastólica (TAS/TAD) anormalmente elevadas, por encima de los valores establecidos como seguros para el infarto cerebral en su fase aguda (185/110 mmHg), conllevan a un aumento de la presión intracraneal y del riesgo de desviación de estructuras de la línea media. Esto se debe a que la disfunción de los mecanismos de autorregulación del flujo sanguíneo cerebral durante la injuria isquémica provoca que la presión (PIC) se modifique de manera directamente proporcional a los cambios de la presión arterial sistémica, de modo que cifras elevadas de PAM inducen un aumento de la PIC. McManus y colaboradores,(34) en un estudio observacional, establecen una relación con un patrón en “J” o en “U”, entre el peor pronóstico funcional y cifras inferiores de presión arterial sistólica de 130mmHg o superiores a 150 mmHg.
La hipoxemia leve se ha manifestado como un fenómeno frecuente en los pacientes con ictus, fundamentalmente en aquellos con enfermedad respiratoria concomitante, aunque también ocurre en otros sin enfermedad conocida, en forma de desaturaciones transitorias nocturnas que guardan relación frecuentemente con la apnea del sueño. Con respecto al tiempo de desaturaciones por debajo del 90 % durante el sueño es lógico pensar que los pacientes con mayor tiempo de hipoxemia tendrán un peor pronóstico, ya que la llegada insuficiente de O2 al cerebro pone en riesgo la supervivencia del tejido en penumbra isquémica.
Según Alexandrov y colaboradores,(35) las desaturaciones repetitivas de oxígeno en el tejido isquémico cerebral e hipercapnia, pueden potenciar la hipoperfusión en el área cerebral isquémica mediante un mecanismo de robo de flujo, dado por la dilatación de los vasos en el área no isquémica, y por tanto, el desvío del flujo sanguíneo del área isquémica a las áreas no isquémicas.
Otros investigadores(36,37) han demostrado la correlación positiva entre el índice de desaturación de oxígeno y el porcentaje de saturación de oxígeno <90 % del tiempo total de registro, con el pronóstico desfavorable del ACV a los 3 meses y el riesgo de muerte durante la fase aguda.
En conclusión, la edad, el promedio de presión arterial media, y el tiempo transcurrido con desaturaciones de O2 menor que 90 % durante el sueño en la fase aguda del ictus, aumentan la probabilidad de un peor pronóstico global desfavorable en los pacientes con infarto cerebral total de circulación anterior. Investigaciones futuras deberían realizarse con muestras amplias y multicéntricas.
Conflicto de interés: Ninguno.
Contribución de los autores: idea conceptual, análisis estadístico, revisión de la literatura, escritura del artículo y revisión crítica, a cargo de Marbelys Guevara Rodríguez.
Financiación: Hospital Provincial Clínico Quirúrgico Arnaldo Milián Castro. Santa Clara.