COLABORADORES
Yanet Morejón del Castillo.
Especialista de I Grado en Medicina General Integral.
Especialista de I Grado en Alergología.
Hospital General Universitario Dr. Gustavo Aldereguía Lima. Cienfuegos.
Luisa Maray Peña Díaz.
Especialista de I Grado en Medicina General Integral.
Residente en Alergología.
Área VIII.
Lic. Gloria Arlenis Suárez Rodríguez.
Licenciada en Filosofía Marxista Leninista.
Profesora Asistente.
Universidad de Ciencias Médicas.
Cienfuegos.
Lic. Rafael Zamora Puerta.
Licenciado en Enfermería.
MSc. en Longevidad satisfactoria.
Hospital General Universitario Dr. Gustavo Aldereguía Lima.
Cienfuegos.
AGRADECIMIENTOS:
Beatriz Navarro González
Estudiante de tercer año en Estomatología.
Universidad de Ciencias Médicas.
Cienfuegos.
Claudia Arano Bosch
Estudiante de tercer año en Estomatología.
Universidad de Ciencias Médicas.
Cienfuegos.
INTRODUCCIÓN
La inmunología, rama de las ciencias biomédicas, ha tenido un desarrollo impetuoso en los últimos años, tanto en el conocimiento de sus aspectos esenciales, como en su aplicación en la práctica médica.
El estudio de la inmunología en sus inicios formaba parte del estudio de la microbiología y se relacionaba principalmente con el estudio de la resistencia a las infecciones. Hoy en día, debido al profundo avance de los conocimientos inmunológicos, estos abarcan ya una serie de fenómenos mucho más extensos que el limitado estudio de la resistencia a las infecciones.
La inmunología moderna se define como el estudio de los fenómenos celulares y moleculares que ocurren cuando el Sistema Inmune reacciona contra cualquier sustancia reconocida como extraña y que le permiten al organismo mantener constante su medio interno frente a sustancias extrañas para él, que pueden ser el producto de alteraciones de los componentes del propio organismo o provenientes del medio exterior.
Un sistema inmunitario, sistema inmune o sistema inmunológico es aquel conjunto de estructuras y diferentes procesos biológicos que ocurren en el interior de un organismo que le protege contra las diferentes enfermedades, identificando y matando a las células patógenas o cancerosas que se van presentando. Además es capaz de detectar una amplia variedad de agentes y tiene la capacidad de reconocer estas sustancias como extrañas al organismo y distinguirlas de las propias permitiéndole a este funcionar correctamente.
El sistema inmunológico es muy importante porque protege al organismo de agentes microbianos patógenos, toxinas, partículas extrañas, células tumorales y procesos autoinmunes. Para mantener el equilibrio biológico se necesita que este sistema funcione normalmente, de manera que constituya una fuerte barrera defensiva contra la invasión de agentes nocivos. La esencia de la función del sistema inmune es su gran capacidad para la discriminación a escala molecular entre lo propio y lo ajeno, o sea, lo que pertenece al organismo y lo que no pertenece, conservando así su individualidad y de ahí la gran importancia del estudio de la inmunología para la práctica médica.
Sin embargo la mayoría de los libros de inmunología, tanto fuera como dentro de nuestro país, al abordar estos temas lo hacen con una gran profundidad en sus contenidos y además muy poco se ha publicado para estudiantes, por otra parte el tecnicismo del lenguaje utilizado en dichos libros, generalmente ofrece dificultad en la comprensión objetiva del contenido.
Las razones anteriores motivaron la creación de este libro que constituye una recopilación, en un lenguaje sencillo y práctico, de la información publicada sobre los temas afines de Inmunología Básica y Clínica dirigido a estudiantes en formación de la Estomatología, de 2do año, y según el programa de estudio. Se utilizaron como fuente para la bibliografía, libros de Inmunología actualizados cuyos autores son expertos en el tema así como se revisaron también artículos de revistas y monografías.
Acerca de la inmunología se describen las definiciones, clasificaciones básicas, así como sus componentes y funciones. Se explica la hipersensibilidad, las inmunodeficiencias y la tolerancia inmunológica como base de las enfermedades dentro de los trastornos inmunológicos y, dentro de ellos, se identifican las gingivitis y periodontitis, la GUNA, la hipersensibilidad a medicamentos, el sida y el síndrome de Sjögren como los relacionados con la Estomatología.
De esta manera quedó confeccionado un Manual, que constituye una recopilación de información publicada sobre inmunología a la que se agregaron aspectos aportados por la experiencia y conocimiento de los autores. Constituye un material de apoyo en los Temas de Inmunología Básica y Clínica para la formación del educando de Estomatología.
Parte 1.-TEMAS DE INMUNOLOGÍA BÁSICA
1.- SISTEMA INMUNOLÓGICO
La función principal del sistema inmunológico (SI) es proteger al organismo de la agresión de agentes extraños de cualquier índole como virus, bacterias, hongos, parásitos o moléculas reconocidas como “no propias”, es decir, que no integren su estructura biológica.
El SI es extraordinariamente complejo y está integrado por diferentes tejidos, órganos, células y moléculas que tienen relaciones muy estrechas para poder responder adecuadamente a los agentes extraños. En condiciones fisiológicas, las células y moléculas que componen el SI, no solamente reconocen componentes microbianos, sino que además tienen la capacidad para reconocer como extraños muchos componentes que no son de origen microbiano y moléculas propias alteradas como las que se forman en las células tumorales. En condiciones patológicas, el SI es capaz de reaccionar contra componentes propios y producir las llamadas enfermedades autoinmunes.
En la actualidad las reacciones coordinadas y reguladas de los componentes del SI para erradicar estímulos agresores o neutralizar sus efectos dañinos se denomina respuesta inmunitaria (RI). Para mantener el equilibrio biológico se necesita que todos los miembros de este sistema funcionen normalmente; por ejemplo, los trastornos por déficit en el número o la función de uno o más componentes del SI dan lugar a las enfermedades por inmunodeficiencia, mientras que los trastornos en la regulación inmunitaria dan lugar a las enfermedades por hipersensibilidad. De manera comprensible y esquemática se puede clasificar la inmunidad en innata o inespecífica, con la que nacemos, y adquirida o específica, que se adquiere durante el crecimiento y adaptación al medio.
Los componentes más importantes del SI son: la piel, las mucosas, los órganos linfoides como las amígdalas, las adenoides, el bazo, el timo, los ganglios linfáticos distribuidos por todo el organismo; proteínas que están presentes en la sangre, como las inmunoglobulinas (Igs), que son los anticuerpos (Acs), y numerosas células leucocitarias, dentro de las cuales tienen una participación muy especial los linfocitos, además de numerosas sustancias producidas por estos órganos y células; por último, los genes del complejo principal de histocompatibilidad (MHC, del inglés, Major Histocompatibility Complex) y el producto de su expresión, los antígenos leucocitarios humanos (HLA, del inglés Human Leukocyte Antigen) que desempeñan un papel central en las respuestas inmunitarias, motivo por el cual son llamados genes de inmunorespuesta.
El sistema inmunitario se encuentra compuesto principalmente por variadas células, dentro de ellas los linfocitos son las células protagonistas del SI, y son conocidos también como células inmunocompetentes, particularidad que se debe al reconocimiento específico del antígeno. Se dividen en linfocito B y linfocito T. Los linfocitos B son los precursores directos de las células plasmáticas; sintetizan y aportan a la circulación las moléculas de Igs responsables de la respuesta humoral. Las inmunoglobulinas son los mediadores de la inmunidad humoral y de varios tipos de reacciones de hipersensibilidad. Por su parte el linfocito T causa reacciones inmunitarias mediadas por células, como es el caso de las respuestas de hipersensibilidad cutánea retardada, el rechazo a injertos, a los tumores y las enfermedades autoinmunes. Por otra parte, el tejido linfoide asociado a mucosas (TLAM) está compuesto por un grupo de tejidos linfoides organizados en folículos que se encuentran presentes en las superficies de las mucosas respiratoria, digestiva y genitourinaria. Pueden presentarse en forma de folículos agregados como en las tonsilas palatinas, linguales, tubarias y faríngeas. Las placas de Peyer también son acúmulos de folículos cercanos a la pared del intestino delgado, responsables de la RI a ese nivel.
Subpoblaciones especializadas de linfocitos T influencian la actividad de otras células, y tanto las células T como las B, se encuentran equipadas con receptores de membrana capaces de reconocer un espectro casi ilimitado de estructuras moleculares diferentes. Además participan en las defensas los polimorfonucleares, los macrófagos, células estructurales (fibroblastos, células endoteliales y del músculo liso) y las células epiteliales entre otros componentes que ayudan a su funcionamiento. Por otra parte hay que tener en cuenta que los patógenos pueden adquirir adaptaciones que le permiten evadir el SI del hospedero e infectar con éxito.
La capacidad total de reconocimiento del sistema inmunológico, por tanto, está dada por la suma de las especificidades aportadas por todas las células inmunocompetentes que lo forman. El sistema inmunológico es nuestro guardián y del mismo depende nuestro equilibrio entre el medio y el individuo, entre salud y la enfermedad en la interacción entre el hospedero y el huésped.
1.1.-Formas fundamentales de la respuesta inmune:
Los encuentros entre el SI de cualquier mamífero y las moléculas extrañas pueden tener tres consecuencias o vías distintas:
- Una respuesta normal de protección denominada inmunidad. En caso de que el estímulo agresor sea un microorganismo patógeno o una partícula inerte, la inmunidad puede ser de dos tipos: eliminatoria o no eliminatoria.
- Una respuesta anormal que produce daño hístico con expresión histopatológica y clínica importante denominada hipersensibilidad. Este tipo de respuesta implica mecanismos de lesión tisular que se observa en varios escenarios, por ejemplo en las enfermedades alérgicas, en los rechazos de injertos y en las enfermedades autoinmunes. Existen dos grandes grupos de hipersensibilidad: inmediata y retardada.
- Una no respuesta a un antígeno específico denominada tolerancia inmunológica.
El SI presentan características particulares sin las cuales es imposible hablar de un sistema especializado en el reconocimiento, erradicación o neutralización de agentes patógenos.
- Características principales del SI:
- Especificidad: reconocimiento de diferencias entre moléculas e incluso entre varias partes de una misma molécula. Garantiza que las RI a un microorganismo sean dirigidas solo a tales dianas.
- Heterogeneidad o diversidad: número total de determinantes antigénicos que el SI es capaz de reconocer en un momento dado. Permite que el SI pueda responder a una amplia variedad de antígenos y para cada sustancia a la que se responde se elabora un efector diferente.
- Autotolerancia o discriminación: el SI en condiciones normales solo reacciona contra moléculas extrañas, respetando siempre las estructuras propias. Multiplicación de los linfocitos específicos de Ag durante la RI. Evita el daño al hospedero durante las RI a Ags extraños.
- Memoria: los contactos ulteriores con la sustancia o elemento extraño modifican la intensidad y calidad de la respuesta. Persistencia por tiempo indefinido de clones de linfocitos específicos de Ag listos para responder.
- La autolimitación u homeostasis: una vez que el Ag agresor ha sido eliminado o neutralizado, se produce eliminación del remanente celular no útil generado durante la RI y se conservan solo las células de memoria. Permite que el organismo pueda recuperar su estado fisiológico de reposo una vez eliminado el estímulo.
- Especialización: generación de RI diferentes.
- Expansión clonal: multiplicación de los linfocitos específicos de Ag durante las RI.
1.2.-Fases de la respuesta inmunitaria:
Todas las respuestas inmunitarias se inician cuando se reconocen los Ags extraños. Esto da como resultado la activación de los linfocitos que reconocen específicamente el Ag y termina en el desarrollo de mecanismos que median la eliminación del Ag.
Así la respuesta inmunitaria específica puede dividirse en:
1) Fase de reconocimiento.
2) Fase de activación.
3) Fase efectora.
4) Fase de homeostasis.
5) Fase de memoria.
1.-Fase de reconocimiento
La RI comienza con el reconocimiento de Ags extraños por los receptores celulares del SI innato, particularmente por las células presentadoras de Ag (CPA). Las principales células que promueven esta y la siguiente fase son las células dendríticas, consideradas como las CPA por excelencia del SI por su eficiencia en la detección de microbios y en la activación de linfocitos T maduros que no han reconocido su Ag específico (vírgenes). Otro tipo de CPA innata, importante por su papel predominantemente efector es el macrófago, más importante para activar a linfocitos T efectores y de memoria. Tanto las células dendríticas como los macrófagos tienen capacidad para ingerir y matar microbios, procesar sus Ags y presentar péptidos derivados de proteínas asociados a moléculas HLA a los linfocitos T. Los linfocitos B, también son considerados CPA pero de la inmunidad humoral, estos expresan en su superficie moléculas de Acs que pueden reconocer proteínas extrañas, polisacáridos, lípidos y otras sustancias extracelulares solubles o unidas a células.
2.-Fase de activación
Esta etapa tiene lugar en los órganos linfoides periféricos, y consiste en el reconocimiento específico del Ag en condiciones adecuadas. Tras la activación, los linfocitos T y B maduros vírgenes específicos del Ag proliferan y se diferencian; y durante estos procesos se expresan nuevos genes celulares que le permiten adquirir nuevas funciones a estos linfocitos (linfocitos activados). Los linfocitos activados incluyen dos tipos celulares; las células efectoras que eliminan el Ag, y las células de memoria que recirculan preparadas para responder a una nueva exposición al Ag. Las células efectoras de los linfocitos B son las células plasmáticas secretoras de Acs, los cuales son secretados a los compartimentos extracelulares (sangre, linfa y tejidos) donde se unen al Ag y promueven los mecanismos que lo eliminan. Los linfocitos T efectores pueden ser de dos tipos funcionales, linfocitos T CD4+ colaboradores (linfocitos TH CD4+; H, del inglés “helper”: colaborador) y linfocitos T CD8+ citolíticos (linfocitos T CD8+ CTL).
3.-Fase efectora
Una parte de los linfocitos activados por el Ag, después de ser generados en los órganos linfoides secundarios, cumplen varios roles. En el caso de los linfocitos TH CD4+ y linfocitos T CD8+, migran a los sitios donde se localiza el agente agresor y desarrollan las funciones que conducen a la eliminación de estos; colaborando con otras células los (linfocitos T CD4+ TH), eliminando células infectadas los (linfocitos T CD8+ CTL) y reclutando o amplificando mecanismos efectores de la inmunidad innata ambos (linfocitos TH CD4+ y linfocitos T CD8+ CTL).
Las fases de memoria y homeostasis fueron referidas anteriormente y están íntimamente relacionadas.
1.3. Categorías de la respuesta inmune:
En los órganos linfoides centrales constantemente se están produciendo linfocitos maduros, los que son liberados a la circulación para iniciar el llamado ciclo de recirculación linfocitaria, que consiste en la capacidad de estas células de transitar repetidamente por los compartimentos intravascular y linfático (órganos linfoides periféricos) en busca de su Ag específico. Los Ags que logran acceder a los espacios intersticiales son presentados a los linfocitos maduros vírgenes en los ganglios linfáticos y los tejidos linfoideos asociados a mucosas, mientras que los que alcanzan la sangre son presentados a las mismas células en el bazo. Las categorías de las RI responden a la Ley de la Dinámica de la RI y varían según propiedades inherentes a los Ags y la cronología de su ingreso al hospedero.
Cuatro categorías básicas definen las RI; latencia, intensidad, duración y memoria. Estas categorías variarán en dependencia de si es un primer contacto con inmunógeno, produciéndose una RI primaria (RIP) o si es la respuesta a un segundo o ulteriores contactos con un Ag, dando lugar a una RI secundaria (RIS).
Latencia: intervalo de tiempo que transcurre desde la penetración del inmunógeno hasta la aparición de efectores (Acs o linfocitos T específicos de Ag) cuantificables de la RI en sangre periférica. Mayor en la primaria.
Intensidad: es la medida cuantitativa de la RI, definida por la concentración de efectores que se alcanza en el máximo de la reacción inmunitaria. Mayor en la secundaria.
Duración: tiempo que media desde la detección de los efectores hasta su desaparición parcial, pues en el caso de la RI humoral, después de la eliminación o neutralización del agente agresor, se producen Acs específicos por un período de tiempo prolongado. Mayor en la secundaria.
Memoria: respuesta incrementada a contactos secundarios y posteriores con el mismo inmunógeno. (Reto o refuerzo). El fondo de células de memoria se genera durante las respuestas primarias frente a Ags timo-dependientes, pero actúa durante las respuestas secundarias y posteriores.
1.3.1. Dinámica de la repuesta inmune:
Ante un primer contacto con un inmunógeno proteico o conjugados hapteno-portador, ocurre una serie de cambios madurativos en los linfocitos específicos de Ag, que conducen a una expansión cuantitativa y diferenciación en células de memoria y células efectoras, desencadenándose así la RI primaria que se caracteriza por tener un período de latencia de aproximadamente de 5 a 7 días, donde predominan los efectores humorales de tipo IgM, la concentración de efectores que se alcanzan es menor, al igual que la duración de la respuesta y es donde se generan los primeros clones de memoria.
Ante contactos sucesivos con el mismo Ag, vuelve a repetirse esta dinámica pero con mayor intensidad y en un tiempo muchísimo más corto; se genera una RI secundaria, caracterizada por un período de latencia más corto, de 3 a 5 días, debido a la activación rápida de los clones de memoria, predominan los efectores humorales de tipo IgG, la intensidad de la respuesta es mucho mayor (10 veces o más), al igual que la duración; se pueden generar nuevos clones de memoria y se expanden ampliamente los clones de memoria generados en la RI primaria. Vale la pena resaltar que la generación de las células de memoria, y por ende de las RI secundarias solo es aplicable en presencia de Ags proteicos con algunas excepciones.
2.-ÓRGANOS DEL SISTEMA INMUNE
Los órganos del SI se clasifican en primarios, secundarios y terciarios, según el modo en que se generan y su función.
Los órganos linfoides primarios o centrales son los sitios donde los linfocitos maduran y ganan la condición de inmunocompetencia en una forma independiente del Ag. En el timo y el hígado fetal maduran los linfocitos T, responsables fundamentales de las RI mediadas por células como el rechazo de injertos y las reacciones de hipersensibilidad retardada. En el hígado fetal y la médula ósea fetal y adulta se maduran los linfocitos B, responsables por su parte de la producción de Acs frente al estímulo antigénico.
Los órganos linfoides secundarios o periféricos se clasifican en capsulados y no capsulados. En ellos, al igual que en los órganos terciarios, ocurren las RI adaptativas, o sea la interacción del inmunógeno con los linfocitos T y B. Los órganos linfoides secundarios están constituidos por el bazo, los ganglios linfáticos y el tejido linfoide asociado a las mucosas (TLAM).
Los órganos terciarios, llamados inducibles, no cumplen ningún programa de desarrollo, sino más bien son inducidos en cualquier sitio del organismo por procesos inflamatorios crónicos secundarios a infecciones, enfermedades autoinmunes y rechazo de trasplantes.
3.-INMUNIDAD INMUNIDAD INNATA o INESPECÍFICA
La RI innata, además de ser la primera línea de defensa del organismo contra las infecciones microbianas, cumple otros dos roles importantes en la defensa del hospedero; estimula la RI adaptativa y elimina células dañadas e inicia los procesos de reparación tisular. Básicamente, la inmunidad innata consta de componentes de barreras, componentes humorales y componentes celulares; y dos tipos de reacciones, la inflamación y la defensa antiviral.
3.1.-Componentes de barreras:
Los componentes de barreras constituyen el primer obstáculo a la entrada de los microorganismos, por tanto, el mantenimiento de su integridad es de crucial importancia.
-
Barreras físicas: piel y mucosas. Superficies epiteliales de las mucosas de los tractos respiratorio, digestivo y genitourinario.
-
Barreras químicas: enzima lisozima de secreciones, jugo gástrico y secreciones de las glándulas sebáceas.
-
Barreras mecánicas: reflejo de la tos y el estornudo, el mucus, el arrastre ciliar, lagrimeo, sudoración, micción y defecación.
-
Barreras biológicas: gérmenes comensales en la piel y los tractos respiratorio, gastrointestinal y genitourinario.
La piel y las superficies epiteliales de las mucosas constituyen la principal interface entre el hospedero y su medio ambiente. Estas interfaces están recubiertas por capas continuas de células epiteliales especializadas que, por estar más estrechamente unidas entre sí que cualquier otro tipo celular, previenen la entrada de los microorganismos.
Las barreras químicas están representadas por moléculas con propiedades químicas particulares depositados en las superficies epiteliales, por ejemplo: el mucus, una secreción viscosa que contiene glicoproteínas llamadas mucinas, dificulta físicamente la invasión microbiana; otro ejemplo son las moléculas peptídicas pequeñas producidas por las células epiteliales y algunos leucocitos, que tienen propiedades microbactericidas y microbacteriostáticas.
La microbiota comensal brinda oposición a la colonización por microbios patogénicos por tres mecanismos básicos: bloqueo físico de la adherencia microbiana patogénica, competencia activa por los micronutrientes y secreción de moléculas con propiedades antimicrobianas.
3.2. Componentes humorales:
- Citocinas (Interleucinas (IL): IL-1, IL-6 y el factor de necrosis tumoral alfa (TNF).
- Sistema del complemento (vías alternativas y de las lectinas).
Este grupo de moléculas solubles, que pueden encontrarse en el plasma y también ser sintetizadas por células, promueven las RI innatas por tres mecanismos principales:
- Opsonización y fagocitosis. La opsonización es la propiedad de ciertos tipos de moléculas, de unirse a las superficies microbianas y potenciar su ingestión es decir la fagocitosis, gracias a la presencia en células fagocíticas (neutrófilos, macrófagos y células dendríticas).
- Promoción de la respuesta inflamatoria. Actuando como factores quimiotáctico, que son capaces de potenciar la quimiotaxis es decir la migración celular a favor de un gradiente de concentración, donde se localiza el proceso infeccioso y estas moléculas atraen más leucocitos al sitio dañado, los activan y facilitan la eliminación del microbio.
3.3. Componentes celulares:
- Macrófagos.
- Leucocitos polimorfonucleares (Neutrófilos).
- Células dendríticas.
- Células NK.
3.4. Tipos de reacciones del SI innato:
El SI innato reacciona de dos maneras distintas ante las agresiones microbianas: la respuesta inflamatoria, que se pone en práctica en grado variable contra todo tipo de agente extraño; y la defensa antiviral que es el modo típico de enfrentar las infecciones virales, pero que también, en menor medida y con menos trascendencia clínica, se aplica ante infecciones por algunas bacterias intracelulares.
La respuesta inflamatoria es un modo eficaz de reacción del sistema inmune innato y que tiene por objetivo separar el tejido infectado o dañado del tejido sano, eliminar el agente causal y reparar el tejido dañado. Esencialmente, la inflamación consiste en fenómenos secuenciales vasculares y celulares interrelacionados.
La defensa antiviral es un modo eficaz de enfrentar las infecciones virales, y constituye una reacción del sistema inmune innato inherente a muchos tipos celulares. Sin embargo, un tipo de célula especializada, las células dendríticas, juegan un rol dominante en este tipo de reacción, pues son la principal fuente de producción de interferones de tipo I (INF-I), que constituye la principal citocina mediadora de estas reacciones. Los interferones de tipo I ejercen sus efectos biológicos en distintas localizaciones y juegan múltiples roles importante en la defensa antiviral.
4.-ANTÍGENO, HAPTENO, INMUNÓGENO Y ALERGENO
Distintos tipos de moléculas extrañas tienen distintas capacidades para unirse a los efectores de la RI, y para generar una reacción inmunitaria cuantitativamente detectable.
4.1.-Antígeno:
Un antígeno es toda sustancia capaz de combinarse con los efectores de la RI (Acs o receptor de Ag de la célula T). Los Acs son capaces de reconocer cualquier tipo de molécula biológica, por ejemplo azúcares, lípidos, hormonas, así como también macromoléculas tales como carbohidratos complejos, fosfolípidos, ácidos nucleicos, y proteínas. Este hecho marca la diferencia con los receptores de Ag de las células T, los que solamente reconocen péptidos.
Existen varias formas de clasificar los Ags, sin embargo, en la práctica se utilizan con mayor frecuencia sólo dos tipos de clasificaciones: según la disparidad genética, y según la dependencia de las células T para producir Acs contra ellos.
4.1.1. Clasificación de los Ags según la disparidad genética:
- Xenoantígenos: aquellos que son característicos de una especie determinada y que por tanto, resultan extraños para los individuos de las demás especies.
- Aloantígenos: aquellos que se encuentran presentes solo en algunos miembros de una determinada especie. Estos Ags están codificados por genes alelos. Por ejemplo, los Ags pertenecientes al sistema de grupos sanguíneos ABO y al MHC.
- Autoantígenos: los componentes del propio organismo normalmente no se comportan como Ags frente al sistema inmune. Sin embargo estos componentes pueden sufrir alteraciones estructurales que les confieran inmunogenicidad. También pueden adquirir esta cualidad si se trata de sustancias que normalmente no se ponen en contacto con el sistema inmune del individuo, si por alguna causa este contacto ocurre. (Por ejemplo proteínas del cristalino).
- Isoantígenos: son los componentes pertenecientes a gemelos monocigóticos, y que por tanto no generan una respuesta inmunitaria cuando son reconocidos de modo cruzado.
4.1.2. Clasificación de los Ags según la dependencia de las células T:
a) Ags timo-independientes (TI): Son aquellos capaces de activar completamente a linfocitos B con receptores específicos para ellos, sin necesidad de la intervención de otro tipo celular. Los ejemplos clásicos de este tipo de Ag son los lípidos, polisacáridos, ácidos nucleicos y sus combinaciones.
b) Ags timo-dependientes (TD): Incluye aquellos Ags que activan solo parcialmente a los linfocitos B con receptores específicos para ellos, y que por tanto requieren la ayuda de los linfocitos TH para activar completamente a los linfocitos B, y llevar a cabo los procesos de proliferación y diferenciación previos a la producción de Acs específicos. Los ejemplos clásicos de este grupo son las proteínas.
4.2.-Hapteno:
Son pequeños grupos químicos bien definidos, casi siempre de bajo peso molecular, que no son inmunógenos por sí mismos sino que necesitan la unión a una molécula transportadora que le confiere inmunogenicidad llamada Carrier y que además solo poseen un sitio de unión a los Acs o determinante antigénico (también llamado indistintamente epítopo), ej: la Penicilina. En este caso, la respuesta inmunitaria va dirigida contra ambos, hapteno y transportador.
Los haptenos casi nunca son proteínas, y las moléculas transportadoras casi siempre son proteicas de gran tamaño molecular. Un hapteno después de su primer enfrentamiento con el organismo receptor puede posteriormente comportarse como un Ag, es decir, unirse al Ac ya formado, sin necesidad de estar unido a la proteína portadora.
4.3.-Inmunógeno:
Toda sustancia que sea capaz de desencadenar una respuesta inmunológica, la cual será específica para el inmunógeno que la produjo. Todo inmunógeno en principio es un Ag, ya que además de estimular al organismo para producir la respuesta inmune es capaz de reaccionar con los efectores de esta. Sin embargo no todo Ag es inmunógeno.
Las principales diferencias entre hapteno e inmunógeno radican en su estructura química, el peso molecular y la necesidad de combinación con otra molécula para generar Acs específicos contra ellos. Los inmunógenos son casi exclusivamente moléculas químicas estructuralmente complejas y de alto peso molecular, pero estos factores no son los únicos asociados a esta importante propiedad.
4.3.1. Factores que determinan la inmunogenicidad:
En el contexto de una RI contra patógenos infecciosos, las proteínas y los polisacáridos son los inmunógenos más potentes; los ácidos nucleicos y los lípidos son antigénicos pero no inmunogénicos, a menos que sean asociados físicamente con proteínas y polisacáridos. La inmunogenicidad no depende únicamente de las propiedades intrínsecas de un Ag, sino también de un número de propiedades del sistema biológico particular con el que se pone en contacto. Concerniente al inmunógeno, cuatro propiedades que reflejan su naturaleza, contribuyen significativamente a la inmunogenicidad: extrañeza, tamaño molecular, composición y complejidad química, y la capacidad de ser procesados y presentados por moléculas HLA en la superficie de células presentadoras de Ags. En relación con el sistema biológico con el cual reacciona el Ag, las propiedades determinantes de la inmunogenicidad incluyen: genotipo del receptor, dosis y vía de administración del Ag, y la administración de sustancias potenciadoras de las RI llamadas adyuvantes.
Extrañeza: para despertar una RI, una sustancia debe ser reconocida como no propia por el sistema biológico. Cuando un Ag es introducido dentro de un organismo, el grado de su inmunogenicidad depende del grado de su extrañeza. Generalmente, a mayor distancia filogenética entre dos especies, mayor la disparidad estructural (y por tanto antigénica) entre ellas.
Tamaño molecular: los inmunógenos más potentes tienen predominantemente una masa molecular de 100 000 daltons (Da). Generalmente, las sustancias con una masa molecular inferior a 10 000 Da son inmunógenos débiles.
Composición y complejidad química: para ser inmunogénica, una sustancia debe tener complejidad química sobre la base de sus constituyentes y estructura. Los homopolímeros sintéticos (polímeros compuestos por un solo aminoácido) tienden a ser débilmente inmunogénicos con independencia de su tamaño molecular. Los copolímeros compuestos de diferentes azúcares o aminoácidos son usualmente más inmunogénicos. Los cuatro niveles de organización de las proteínas, -primario, secundario, terciario y cuaternario- contribuyen a la complejidad estructural de las proteínas, influyendo así en su inmunogenicidad.
Susceptibilidad al procesamiento y presentación antigénica: la generación de Acs y linfocitos T efectores específicos de Ag requiere la interacción de linfocitos T vírgenes con los Ags que han sido procesados y presentados por moléculas HLA. Las macromoléculas grandes, insolubles, generalmente son más inmunogénicas que aquellas pequeñas, solubles, debido a que las moléculas grandes son rápidamente fagocitadas y procesadas. Las macromoléculas que no pueden ser degradadas y presentadas por moléculas HLA son pobres inmunógenos.
Constitución genética del animal huésped: la intensidad y calidad de las RI están influenciadas en gran medida por el fondo genético del sistema biológico que reacciona a un inmunógeno. Numerosos experimentos con inmunógenos simples definidos han demostrado que el control genético de las RI es comandado por muchos genes, pero principalmente por los genes del MHC, implicados en la presentación de Ags a los linfocitos T.
Dosis del inmunógeno y vía de administración: la cantidad y el número de dosis de inmunógeno necesaria para poder inducir una respuesta inmune óptima es variable para los distintos tipos de inmunógenos. Por tanto, un exceso o un déficit podrían inducir una RI débil o una “no respuesta inmunitaria”, fenómeno llamado tolerancia. La inmunogenicidad también está afectada por la vía de administración del Ag. Los Ags pueden administrase por dos vías fundamentales: enteral y parenteral. La vía parenteral incluye: intradérmica, subcutánea, intramuscular, intravenosa e intraperitoneal. La vía de administración del Ag se elige según otros factores, como por ejemplo, la naturaleza del Ag en cuestión, la dosis óptima, el objetivo de la inmunización, etc.
Adyuvantes: los adyuvantes son compuestos que potencian la inmunogenicidad de los Ags cuando son mezclados y administrados con él. Los adyuvantes son frecuentemente utilizados para potenciar las RI cuando un Ag tiene baja inmunogenicidad, o cuando se dispone de pequeñas cantidades del mismo.
4.4. Alérgeno:
Muchos compuestos químicos en individuos con cierta predisposición genética, generan una RI con un patrón de respuesta de tipo TH2. Estas sustancias antigénicas son, con escasas excepciones, de carácter exógenas y medioambientales. Pueden ser proteínas o sustancias químicas unidas a proteínas, y tienen en común la formación de Acs de tipo IgE desencadenando un mecanismo de hipersensibilidad tipo I anafiláctica. Estas sustancias son llamadas alérgenos.
5.-SISTEMA DEL COMPLEMENTO
Descrito por Jules Bordet, al observar que existía algo en el suero que lisaba las células pero era un factor termolábil en relación a los Acs que son estables al calor. En 1907 Ferrata inicia la caracterización de sus componentes utilizando métodos de diálisis. Los componentes que se iban descubriendo iban recibiendo denominaciones a base de números tras la letra "C".
El sistema del complemento es una cascada enzimática, constituida por más de 30 proteínas séricas y de membrana que interactúan entre sí y con otras moléculas del SI en forma altamente regulada para cumplir varias actividades biológicas importantes. Este sistema constituye uno de los más importantes mecanismos efectores de la inmunidad innata y es uno de los principales mecanismos efectores de la inmunidad adaptativa. Existen otras cascadas proteolíticas en el organismo como: la coagulación sanguínea y el sistema de la cinina.
5.1.-Activación del sistema de complemento:
El sistema del complemento es activado por microorganismos, y por Acs unidos a microorganismos y otros Ags. Su activación incluye la proteólisis secuencial de proteínas para generar enzimas con actividad proteolítica. Las proteínas que adquieren capacidad proteolítica por acción de otras proteasas son llamadas cimógenos. La participación de cimógenos en cascadas proteolíticas permite una tremenda amplificación y eficiencia, pues cada molécula enzimática activada en una etapa puede generar múltiples moléculas enzimáticas activadas en la siguiente etapa.
Los productos del complemento activado se unen covalentemente a las superficies microbianas, a Acs unidos a microorganismos y otros Ags, y a cuerpos apoptósicos. Esta particularidad asegura que la activación completa del sistema del complemento, y por tanto sus funciones biológicas, sean limitadas a las superficies microbianas o a sitios de inmunocomplejos (ICs) y no ocurra en la sangre.
La activación del complemento es inhibida por proteínas reguladoras solubles presentes sobre células normales del hospedero y ausentes en los microorganismos.
5.2.-Cascada del complemento:
Durante la progresión de la cascada del complemento, la proteólisis enzimática sobre los distintos componentes genera dos segmentos de tamaños diferentes, al de mayor tamaño se designa con la denominación del componente original seguido de la letra "b", y al fragmento de menor tamaño se designa con una "a" tras el nombre del elemento original; por ejemplo la rotura del C3 genera un fragmento grande, denominado C3b y un fragmento pequeño, el C3a, aunque por motivos históricos hay excepciones, tal como ocurre con los derivados de C2, donde el fragmento grande se denomina C2a, y el pequeño C2b.
Existen tres vías principales de activación del complemento: la vía clásica, la vía alternativa y la vía de las lectinas. La vía clásica pertenece a la inmunidad adaptativa, mientras que las restantes vías pertenecen a la inmunidad innata.
5.2.1. Vías de activación del complemento:
Existen tres vías principales de activación del complemento: la vía clásica, la vía alternativa y la vía de las lectinas. La vía clásica pertenece a la inmunidad adaptativa, mientras que las restantes vías pertenecen a la inmunidad innata.
Aunque las tres vías son iniciadas de diferentes maneras, todas conducen al evento central en la activación del complemento, la formación de una enzima llamada C3 convertasa y luego los restantes eventos de la cascada son iguales. El proceso completo de activación del complemento, virtualmente consta de dos fases; los eventos tempranos y los eventos tardíos. Con independencia de la vía de activación, los eventos tempranos culminan en la formación de una enzima C5 convertasa y la escisión del componente C5. Los eventos tardíos comienzan con la generación del componente C5b secundario a la fragmentación del componente C5, y culminan en la formación de un complejo multimolecular citocida llamado “complejo de ataque a la membrana" (CAM).
5.2.1. Eventos tempranos. Vía clásica:
Denominada así porque se descubrió primero. Esta vía es activada por ICs formados por la unión de los Acs IgG (IgG1-IgG3) e IgM, unidos a los microorganismos completos o sus moléculas, los que reclutan directamente el componente C1, poniendo en marcha una cascada.
C1 es una molécula pentamérica grande constituida por una subunidad de C1q, dos subunidades de C1r y dos subunidades de C1s mantenidas juntas en un complejo dependiente de calcio. El C1q es un hexámero donde cada subunidad está constituida por un tallo colágeno y una cabeza globular en su extremo amino-terminal. El C1q necesita al menos 2 cadenas pesadas de Igs para activarse. Se requieren entonces al menos dos moléculas de IgG y solo una molécula de IgM para reclutar el complejo C1 y activar esta vía. Esto solo sucede si el antígeno es multivalente.
La unión de C1q a Fc de la IgG o IgM, activa a las serinas proteasas C1r-C1s. El C1s escinde a la siguiente proteína de la cascada C4 que sufre proteólisis dando lugar a un fragmento mayor C4b y otro menor C4a con efectos biológicos que fluye libremente mientras que C4b se une al IC que ha fijado C1. C4b unido al IC es muy propenso a reclutar la siguiente proteína del complemento C2, el cual también sufre proteólisis por la enzima C1s, fraccionándolo en un fragmento mayor C2b y otro menor C2a. El fragmento C2a es muy reactivo, de modo que tiende a unirse a C4b fijado al IC para formar el complejo con actividad proteolítica C4b2a, que constituye la C3 convertasa de la vía clásica.
El evento posterior lo constituye la conversión de C3 en un fragmento mayor, C3b y otro menor, C3a. C3a fluye libremente y es responsable de actividades biológicas particulares, mientras que C3b también tiene propensión a unirse al IC y seguir dos posibles destinos de crucial importancia: o bien puede unirse a la C3 convertasa para formar la C5 convertasa (C4b2a3b), o bien puede ser el punto de partida de la formación de la C3 convertasa de la vía alternativa.
La C5 convertasa formada es responsable de la escisión del componente C5 en un fragmento menor C5a, con funciones biológicas particulares y otro mayor C5b, que constituye el punto de partida de los eventos de la fase tardía del complemento activado.
Algo a destacar es que existen algunos activadores no clásicos de esta vía que interactúan directamente con C1q sin la necesidad de Acs, dando lugar a la activación de C1; por ejemplo las proteínas llamadas pentraxinas dentro de las cuales tenemos la proteína C reactiva (CRP), la proteína amiloide sérica P (SAP) y la pentraxina 3 (PTX3), que son receptores solubles de la inmunidad innata y reconocen ciertas moléculas en las paredes bacterianas y células apoptósicas. Esto en la mayoría de casos ayuda a los procesos de defensa naturales del organismo y a la eliminación de substancias de desechos.
5.2.2. Eventos tempranos. Vía alternativa:
Es la vía filogenéticamente más primitiva. No requiere la participación de Acs. Su principal estímulo activador es el microbio y la presencia de múltiples componentes de las superficies microbianas. Esta vía está en un estado de activación continua y de bajo nivel del componente C3, que genera C3b, denominada activación constitutiva o basal de C3. En ausencia de microorganismos o Ags extraños, la cantidad de C3b producido es inactivada por hidrólisis espontánea o por el factor H.
La proteína C3 contiene un enlace tioéster reactivo (TER) en el dominio tioéster. Cuando se escinde C3 las moléculas C3b sufren un cambio tridimensional y se expone el enlace TER a través del cual puede unirse por enlace covalente a la superficie celular.
Cuando C3b se une a una superficie microbiana, conocida como “superficie protegida” (evade la acción del Factor H), se expone también una zona de unión para una proteína plasmática llamada Factor B y forma un complejo, el cual es escindido por acción de una serina proteasa el factor D la que libera 2 fragmentos en presencia de magnesio, un fragmento menor que difunde libremente Ba, y otro mayor Bb, que queda unido a C3b para formar un complejo C3bBb con actividad proteolítica, y que constituye la C3 convertasa de la vía alternativa.
Este complejo es muy inestable, por lo que requiere de otro componente para estabilizarse y aumentar el tiempo de vida funcional, la properdina. La properdina es el único regulador conocido del sistema del complemento. Ahora el complejo recién formado C3bBbP se une a la propia C3 convertasa y da lugar a un complejo C3bC3bBb que actúa como C5 convertasa de la vía alternativa y escinde a C5 en C5a y C5b. De aquí en adelante ocurre básicamente lo mismo que en la vía clásica.
Debido a que la vía alternativa no implica una reacción Ag-Ac, es una de las primeras líneas de defensa contra los microorganismos invasores, capaz de funcionar incluso antes de que una persona se inmunice contra el microorganismo.
5.2.3 Eventos tempranos. Vía de la lectina:
Esta vía se inicia por el enlace de la lectina de unión a manosa (MBL) sobre la superficie de las bacterias que contienen polisacáridos ricos en manosa y fructuosa. La MBL es miembro de la familia de las colectinas y tiene una estructura hexamérica muy similar a C1q. Después que la MBL se une a la superficie de los microbios, se asocia a dos cimógenos, que son serina proteasas llamadas MASP 1, MASP 2 y MASP 3 (serinas proteasas asociadas a MBL) con funciones similares a C1r y C1s de la vía clásica. Estas enzimas actúan sobre los componentes C4 y C2 de la misma manera que C1s; de modo que ocurre lo mismo que en la vía clásica hasta la escisión de C5.
5.2.4. Eventos tardíos de la cascada:
Corresponde a las reacciones finales del sistema de complemento, común para todas las vías de activación. Se inicia con la formación del componente C5b por acción de la C5 convertasa sobre el componente C5. La fracción C5b que permanece unida a las proteínas del complemento en la superficie celular, capta C6 y C7 de la fase fluida, formando un complejo estable C5b67. El componente C7 es hidrófobo y se inserta en la bicapa lipídica de la membrana celular donde recluta el componente C8, verdaderamente hidrofóbico y que tiene la capacidad de lisar células, el nuevo complejo C5b678 se inserta más firmemente en la membrana y adquiere la capacidad de interactuar con muchas moléculas C9 formando el complejo C5b6789 llamado complejo de ataque a la membrana (MAC).
La inserción secuencial de los monómeros de C9 abre poros en la membrana celular, facilitando la entrada masiva de agua e iones, y como resultado se produce la lisis osmótica de la célula diana. C9 es estructuralmente homólogo a las perforinas, proteínas liberadas por los linfocitos T citotóxicos y las células NK, y que es también responsable de la formación de poros en la membrana de las células diana correspondiente.
5.3. Funciones biológicas del sistema del complemento:
Las actividades biológicas del complemento son muy diversas y son mediadas por los distintos productos que genera la cascada; sin embargo se reconocen tres funciones principales del complemento: lisis de microorganismos, promoción de la opsonización y fagocitosis, y estimulación de la respuesta inflamatoria. Otras funciones no menos importantes del sistema del complemento son la neutralización de virus, el mejoramiento de la RI humoral y la solubilización de ICs circulantes respectivamente.
Lisis de microorganismos:
Uno de los productos más importantes de la cascada del complemento es la formación del MAC en las superficies celulares donde se ha activado el complemento. El MAC tiene el potencial para romper membranas celulares microbianas y no microbianas, por ejemplo: la gran mayoría de bacterias Gram negativas, algunas bacterias Gram positivas, parásitos, virus, eritrocitos y células nucleadas; sin embargo en el ámbito clínico, las deficiencias en componentes del MAC solo han sido asociadas a una susceptibilidad incrementada a infecciones con bacterias del género Neisseria.
Opsonización y fagocitosis:
Uno de los productos de la cascada de complemento, el C3b, que es la opsonina principal del complemento, se une a una amplia variedad de superficies microbianas, y promueve su ingestión uniéndose a receptores específicos expresados por los fagocitos, principalmente por macrófagos y neutrófilos.
Efectos inflamatorios:
Los productos de la activación del complemento C3a, C4a y C5a potencian la respuesta inflamatoria por dos mecanismos generales; en primer lugar activan las células endoteliales induciendo en ellas un aumento de la permeabilidad vascular y de la expresión de moléculas de adhesión para los leucocitos; y en segundo lugar potencian el reclutamiento al sitio dañado y la activación de neutrófilos y mastocitos. Todas estas acciones contribuyen a la eliminación del agente agresor en el sitio donde se ha activado el complemento. C3a y C5a, son llamados anafilotoxinas por su propiedad de activar a los mastocitos y los basófilos e inducir reacciones de tipo anafilácticas.
Neutralización de virus:
Las enzimas del complemento y los productos de sus acciones pueden atacar las estructuras de algunos virus y por tanto, hacerles perder su virulencia. C3b induce la agregación de partículas virales formando una capa gruesa que bloquea la fijación de los virus a la célula hospedera. Este agregado puede ser fagocitado mediante la interacción con receptores del complemento en las células fagocíticas.
Mejoramiento de la RI humoral:
El sistema de complemento tiene también efectos importantes en las RI humorales. Como consecuencia de las RI, muchos Ags solubles quedan recubiertos de C3b y su producto de escisión, C3d. Los linfocitos B y las células dendríticas foliculares de los órganos linfoides secundarios expresan un receptor específico para C3d; de modo que la unión simultánea del receptor de Ag del linfocito B a su Ag específico, y del CD21 a C3d mejora la activación del linfocito B y, por ende la producción de Acs específicos. Por otro lado, en el caso de las células dendríticas foliculares, la unión a los complejos Ag-C3d mediante su receptor de C3d y a los complejos Ag-C3d-Ac mediante su receptor de Fc de las Igs promueve la selección de linfocitos B de alta afinidad.
Aglutinación:
Los productos del complemento también alteran las superficies de los microorganismos invasores, haciendo que se adhieran entre sí, y favoreciendo así la aglutinación.
Quimiotaxis:
Los fragmentos del complemento C3a y C5a provocan la quimiotaxis de los neutrófilos y de los macrófagos, haciendo que un número elevado de estos fagocitos migren al sitio de agresión microbiana.
6. INMUNIDAD ESPECÍFICA, ADAPTATIVA O ADQUIRIDA
Las RI adaptativas son específicas de Ag y especializadas, propiedad que le permite generar reacciones adaptadas a las propiedades de patógenos específicos. La habilidad de montar RI específicas mejoradas se mantiene en el organismo gracias a las células de memoria. Si un patógeno infecta a un organismo más de una vez, estas células de memoria desencadenan una respuesta específica para ese patógeno cualitativa y cuantitativamente superior a la anterior, con el fin de eliminarlo rápidamente.
Las células del sistema inmunitario adaptativo son una clase especial de leucocitos, llamados linfocitos. Las células B y las células T son las clases principales de linfocitos y derivan de células madre hematopoyéticas pluripotenciales de la médula ósea. Las células B están involucradas en la respuesta inmune humoral, mientras que las células T lo están en la respuesta inmune celular. Las células B y T contienen moléculas receptoras que reconocen objetivos o blancos específicos.
6.1. Inmunidad humoral: linfocitos B, anticuerpos e inmunoglobulinas:
Las células B tienen como receptor de Ag (RCB, receptor de la célula B) en su superficie, moléculas de Ac en su forma transmembrana, y reconocen patógenos completos sin la necesidad de que los Ags sean procesados previamente. Asociadas estrechamente al RCB, se encuentra otro conjunto de moléculas llamadas “correceptor” que también son importantes en la generación de RI humorales, CD19, CD21 y CD81. CD19 es una molécula transmembrana que emite señales activadoras cuando CD21 se une a su ligando C3d del complemento (C3d es un producto de la escisión de C3b mediada por la molécula reguladora del complemento Factor I), mientras que CD81 mantiene unidas CD19 y CD21.
Cada linaje de células B expresa en su superficie RCB de especificidades diferentes, de forma que el conjunto completo de RCB de un organismo, representa todos los Acs que ese organismo es capaz de fabricar. Este complejo Ag-Ac pasa al interior del linfocito B donde es procesado por proteólisis y descompuesto en péptidos.
El linfocito B muestra entonces estos Ags peptídicos en su superficie unidos a moléculas del MHC de clase II. Esta combinación forma un complejo péptido-MHC que es reconocido por un linfocito TH CD4+ cuyos receptores sean específicos del complejo. La célula TH CD4+ entonces potencia la activación de los linfocitos B mediante la liberación de linfoquinas (citoquinas producidas por linfocitos) y contacto intercelular directo.
Cuando el linfocito B ha sido activado comienza a dividirse y su descendencia produce millones de copias del Ac que reconoce a ese Ag. Estos Acs circulan en el plasma sanguíneo y en la linfa, se ligan a los patógenos que portan los Ags específicos, dejándolos marcados para su destrucción por la activación del complemento o al ser ingeridos por los fagocitos. Los Acs también pueden neutralizar ciertas amenazas directamente, ligándose a toxinas bacterianas o interfiriendo con los receptores que virus y bacterias emplean para infectar las células.
6.2. Inmunidad celular: Linfocitos T, citoquinas e interferones:
Las células T reconocen un objetivo no-propio, como un patógeno, solo después de que los Ags (pequeños fragmentos del patógeno) han sido procesados y presentados en combinación con las moléculas propias del MHC por CPA adecuadas. La molécula de la superficie de los linfocitos T que lleva a cabo el reconocimiento del Ag se denomina receptor de Ag de la célula T (RCT, receptor de la célula T). Durante su maduración en el timo, todos los linfocitos T son analizados, de modo que solo maduran aquellos cuyos RCT pueden reconocer complejos péptidos extraños-MHC propio (pMHC).
Existen dos grandes grupos de linfocitos T en base a los componentes del RCT, los linfocitos T αβ (alfa-beta) y los linfocitos T γδ (gamma-delta). Las células T αβ en su gran mayoría pertenecen a la inmunidad adaptativa, y su RCT está formado por una cadena α y una cadena β; mientras que todas las células T γδ pertenecen a la inmunidad innata, y su RCT está compuesto por una cadena γ y una cadena δ. Las células T αβ pueden ser de dos tipos según el tipo de correceptor antigénico adyacente al RCT: las células T CD4+ y las células T CD8+. Los correceptores CD4 y CD8 son iguales en todas las células que lo expresan, y son los encargados de reconocer regiones monomórficas o invariantes de las moléculas MHC de clases II y I respectivamente; por lo que los linfocitos T que expresan estos correceptores reconocen solo Ags peptídicos asociados a estos tipos de moléculas.
Además de los correceptores CD4 y CD8, los TCR están rodeados de otras moléculas de membrana que no participan en el reconocimiento del Ag pero cumplen otras funciones importantes, como por ejemplo, en la coestimulación directa para la activación, en la estabilización de la adhesión entre el complejo receptor (RCT y CD4/CD8) y el complejo pMHC, y en la transducción de señales. La activación de los linfocitos es un proceso regulado dependiente de la integración de señales activadoras e inhibidoras, mediadas respectivamente por enzimas tirosinas quinasas y tirosinas fosfatasas. Inicialmente, las interacciones específicas entre los RCT y los complejos pMHC activan tirosinas quinasas, las que a su vez activan muchas cascadas bioquímicas que finalmente convergen en la activación de múltiples factores de transcripción, que son los responsables de la expresión de nuevos genes celulares y de la adquisición de nuevas funciones. Posteriormente, cuando la célula ha alcanzado un grado de activación óptima, las cascadas bioquímicas activadas por tirosinas quinasas son inhibidas por tirosinas fosfatasas y como resultado final los linfocitos quedan listos para proseguir con los procesos de proliferación y diferenciación celular, cuyo resultado final es la formación de linfocitos efectores y de memoria. En general los linfocitos efectores y de memoria se activan más rápida y eficientemente que los linfocitos maduros vírgenes.
Desde una perspectiva funcional más que fenotípica (marcadores de membrana expresados), hay tres subtipos principales de células T CD4+ efectoras: las células TH1, TH2 y TH17, que solo reconocen Ags peptídicos asociados a moléculas del MHC de clase II, producen citocinas distintas, actúan sobre células diferentes y se oponen a infecciones contra distintos tipos de patógenos; mientras que solo existe un subgrupo de células T CD8+ efectoras, las CTL, que reconocen Ags peptídicos asociados a moléculas del MHC de clase I. Las células T γδ no expresan CD4 ni CD8, por lo que no reconocen Ags acoplados a moléculas MHC.
6.2.1 Linfocitos T colaboradores. TH1 CD4+:
Los linfocitos TH1 CD4+ son los orquestadores de la inmunidad adaptativa, pues contribuyen a determinar qué tipo de RI ofrecerá el hospedero ante un patógeno particular. Estos linfocitos no tienen actividad citolítica ni eliminan patógenos directamente; en cambio, controlan las RI dirigiendo otras células para que lleven a cabo estas tareas.
La activación de un linfocito T colaborador hace que libere citocinas que influyen en la actividad de muchos tipos de células. Las señales de citocinas producidas por los linfocitos T colaboradores mejoran la funciones microbicida y de reparación tisular de los macrófagos, promueven la diferenciación de los linfocitos B en células plasmáticas secretoras de todas las clases de Acs, potencian las respuestas inflamatorias y las propiedades adhesivas del endotelio vascular, promueven la activación de las células dendríticas haciéndolas más eficientes en la presentación de Ags, y favorecen la diferenciación de los linfocitos T CD8+ maduros vírgenes en CTL.
6.2.2 Linfocitos T CD8+ CTL:
Los linfocitos T CD8+ CTL son un subgrupo de células T que matan células infectadas por virus y algunas bacterias intracelulares, y células cancerosas principalmente. Al igual que las células linfocitos B cada tipo de célula T reconoce un Ag diferente. Las células T CD8+ CTL son activadas cuando su RCT se liga a su complejo específico pMHC de clase I de otra célula. Cuando una célula T CD8+ CTL interactúa con su célula diana, libera moléculas citotóxicas que forman poros en su membrana plasmática, permitiendo la entrada de agua y electrolitos. Esto provoca el estallido osmótico de la célula diana y por tanto su muerte. La muerte de células infectadas tiene una gran importancia, pues elimina el reservorio de la infección. En ocasiones la activación de células T CD8+ vírgenes y su diferenciación en linfocitos T CD8+ CTL puede requerir la participación de las células TH CD4+, debido a que no se generan fuertes RI innatas o no son directamente infectadas las CPA. Tales circunstancias incluye infecciones virales latentes, rechazo de órganos trasplantados, y reacciones contra tumores.
6.2.3 Citoquinas:
Las RI son posibles gracias a interacciones complejas entre células inflamatorias, linfoides y hematopoyéticas mediadas por un grupo de moléculas proteicas llamadas colectivamente citocinas, término que refleja su rol en la comunicación intercelular. Las citocinas son proteínas o glicoproteínas de bajo peso molecular secretadas por una amplia variedad de células en respuesta a numerosos estímulos. Las actividades biológicas de estas proteínas igualmente son múltiples y variadas, pero en el marco del SI, están encaminadas a influir en el desarrollo y las funciones de células efectoras inmunitarias, y de otras células propiamente no inmunitarias, pero que colaboran en la defensa del organismo de muchas maneras. Existen varias maneras de clasificar a las citocinas, sin embargo es prácticamente imposible enmarcar una o un conjunto de citocinas en una clasificación única.
6.2.3.1. Propiedades generales de las citocinas:
- Inducen la activación de receptores de membrana específicos en las células dianas, iniciando vías de transducción de señales que modifican la expresión de genes celulares.
- La unión citocina-receptor es en general de muy alta afinidad, por lo que producen efectos biológicos a concentraciones muy bajas.
- Actúan de modo autocrino (sobre la propia célula), paracrino (sobre células vecinas) y endocrino (sobre células situadas a distancia).
- Estimulan la producción y secreción de otras citocinas, evento denominado “cascada de citocinas”.
- Una misma citocina puede actuar sobre múltiples células dianas, evento denominado “pleitropismo”.
- Citocinas diferentes pueden tener el mismo efecto biológico cuando actúan sobre la misma célula diana, evento denominado “redundancia”.
- Algunas citocinas inhiben o se oponen a los efectos de otras citocinas, evento denominado “antagonismo”; mientras que otras citocinas promueven o incrementan los efectos de otras, evento denominado “sinergismo”.
6.2.3.2. Citocinas e inmunidad celular:
Durante la inflamación los macrófagos y otras células presentan los Ags a los linfocitos TH CD4+, los cuales son muy importantes (si no los principales) moduladores intrínsecos del SI regulando las dos vías principales de defensa específica: celular y humoral, a través de la secreción de citocinas.
Es relevante mencionar que el grupo de citocinas secretadas por los linfocitos TH CD4+ polariza la RI hacia una predominantemente citotóxica o celular o hacia el otro extremo predominantemente humoral, esas respuestas son antagónicas, pero no mutuamente excluyentes entre sí; lo que significa que toda RI es bivalente (celular y humoral), pero siempre predomina una u otra en dependencia de la naturaleza del patógeno. Esto se explica por el hecho de que durante el procesamiento y la presentación antigénica, los péptidos derivados de Ags exógenos (provenientes del medio extracelular) son presentados predominantemente asociados a MHC de clase II, pero una pequeña parte pasan a la vía de presentación del MHC de clase I, que normalmente presenta péptidos derivados de proteínas endógenas (provenientes del medio intracelular); lo análogo ocurre con la vía de presentación de péptidos derivados de proteínas endógenas. Este mecanismo de cruzamiento de las vías de presentación antigénica se llama presentación cruzada.
Los linfocitos TH que inducen RI celular se denominan TH1 mientras que aquellos que favorecen las RI humorales a favor de ciertas clases de Acs son tanto TH1 como TH2. Dos son las principales citocinas de inmunidad celular o TH1: interferón gamma (IFN-γ) y la interleucina 2 (IL-2), también conocido como factor de crecimiento de las células T (véase tabla 5.1).
6.2.4. Interferones:
Los interferones (INF) son proteínas producidas naturalmente por el SI de la mayoría de los animales como respuesta a agentes externos, tales como virus y células cancerígenas. En los seres humanos hay tres tipos principales de interferón: los INF tipo I, de los cuales los más importantes son los INF α y β; los INF tipo II, representados por el INF-γ; y los IFN tipo III, representados por 3 isoformas diferentes de INF-λ.
7. INMUNIDAD E INMUNIZACIÓN
Inmunidad es un término muy general que se refiere a un estado de protección; pero en el ámbito médico significa protección contra las enfermedades infecciosas. Inmunización se refiere a todo el proceso de inducir inmunidad en un hospedero. La inmunidad puede ser adquirida de modo impredecible por la vía natural (inmunidad natural); o por el contrario mediante participación de la mano del hombre (inmunidad artificial). En el proceso de adquirir inmunidad el hospedero puede elaborar sus propios elementos efectores (inmunidad activa), o bien recibir los elementos efectores ya elaborados en otro u otros hospederos de la misma especie (inmunidad pasiva).
7.1. Inmunidad activa:
La elaboración de los propios elementos efectores por el hospedero ofrece la importante ventaja de la adquisición de memoria inmunológica, que puede ser de media o larga duración según la ocurrencia de múltiples factores; y la desventaja de que requiere un periodo de tiempo relativamente corto para generarse. La inmunidad activa puede ser también generada artificialmente a través de la vacunación o inmunización, o naturalmente por medio de las enfermedades infecciosas. El principio en que se basa la vacunación consiste en introducir un Ag de un patógeno para estimular al SI y desarrollar inmunidad específica contra ese patógeno particular sin causar la enfermedad asociada con ese microorganismo.
Esta deliberada inducción de una RI es efectiva porque explota la especificidad natural del sistema inmunitario, así como su inducibilidad. Puesto que las enfermedades infecciosas constituyen una de las causas más frecuentes de muerte en la población humana, la vacunación representa la manipulación más eficaz del SI que ha desarrollado la humanidad para prevenir este tipo de enfermedades.
Casi todas las vacunas virales están basadas en virus vivos atenuados, mientras que la mayoría de las vacunas bacterianas están basadas en componentes o fragmentos no celulares de bacterias, incluyendo componentes inofensivos de toxinas. Dado que muchas vacunas acelulares derivadas de Ags no inducen una respuesta adaptativa lo suficientemente fuerte, a la mayoría de las vacunas bacterianas se les añaden adyuvantes que activan las CPA del SI innato para potenciar la inmunogenicidad.
7.2. Inmunidad pasiva:
La inmunidad pasiva ofrece la ventaja de puede ser transferida inmediatamente cuando sea necesario, pero la desventaja de que brinda protección generalmente de corta duración, desde unos pocos días a algunos meses. Los recién nacidos no han tenido una exposición previa a los microbios y son particularmente vulnerables a las infecciones. La madre les proporciona protección pasiva natural de dos maneras importantes; durante el embarazo, la IgG es transportada de la madre al feto directamente a través de la placenta, así los bebés humanos tienen altos niveles de Acs ya desde el nacimiento y con el mismo rango de especificidad contra Ags que su madre. La leche materna también contiene concentraciones elevadas de IgA y bajas de IgG, que al llegar al intestino del bebé le protegen de infecciones hasta que este pueda sintetizar sus propios Acs.
En la práctica médica, la inmunidad pasiva puede ser también transferida artificialmente de un individuo a otro a través de suero rico en Acs, o de preparados inmunoglobulínicos purificados. En el modo experimental es posible transferir inmunidad celular mediante la administración de linfocitos T y células NK purificados extraídos de otro hospedero de la misma especie.
8.- INMUNOLOGÍA DE LA CAVIDAD BUCAL
Las mucosas constituyen la puerta de entrada para muchos agentes patógenos y el lugar de contacto con diferentes Ags, ambientales, alimentarios, etc. Al nivel de las mucosas existe un contacto íntimo entre organismo y medio ambiente. La mayoría de los agentes infecciosos llegan al cuerpo a través de las mucosas, y el moco adherido a la superficie constituye una parte esencial del sistema inmune mucosal.
En las mucosas tiene lugar una respuesta inmune con características especiales: respuesta inmune asociada a mucosas. (MALT) Esta respuesta inmune se desarrolla a partir del tejido linfoide asociado a las mucosas. Cuando penetra un agente nocivo se desencadena un proceso a nivel de las mucosas, donde la adherencia bacteriana constituye un paso clave en el desarrollo del proceso patológico; el agente infeccioso permanece en el hospedero, ganando acceso a los nutrientes a través de este mecanismo de adherencia.
8.1.-Microbiología bucal:
8.1.1. Flora normal de la boca:
Desde el momento del nacimiento el cuerpo humano se infecta. Durante la vida, la piel y las mucosas se encuentran expuestas a un ambiente lleno de microorganismos, que albergan gran variedad de especies bacterianas que se mantiene de una forma permanente o transitoria sobre sus superficies.
Al nacer, la cavidad bucal es estéril, pero a las pocas horas es colonizada por microorganismos que provienen de los alimentos y otros tipos de contacto. Inicialmente se observa una gran variedad de microorganismos pero a medida que pasa el tiempo parece una forma selectiva producto de los factores ecológicos.
Los estreptococos son los microorganismos que primero colonizan la cavidad bucal y entre ellos se ha comprobado que el Estreptococos salivarius se encuentra principalmente en la lengua. Experimentalmente se ha demostrado que este microorganismo se adhiere con facilidad a las superficies epiteliales pero no a las superficies dentales. En cambio los Estreptococos mutans y Estreptococos sanguis, no hacen su aparición hasta que no se produce la erupción de los dientes.
Otros microorganismos colonizan durante etapas posteriores de la vida del hospedero que favorecen sus condiciones de desarrollo, por ejemplo las espiroquetas y los bacteroides colonizan la cavidad bucal durante la pubertad.
En la mayoría de las zonas bucales predominan los estreptococos Gram positivos y los microorganismos filamentosos. Existen considerables variaciones en la distribución de las bacterias bucales con respecto a su nivel de infección entre los individuos y aún entre poblaciones localizadas; la razón para estas diferencias no está clara pero se sabe que el Estreptococo mutans está localizado especialmente en las áreas retentivas, mientras que el Estreptococos sanguis y el Estreptococos mitis colonizan zonas de superficie más amplia. Las espiroquetas (Treponema dentícola) y los bacilos anaerobios gram negativos (Bacteroides melaninogénicus) se localizan en la zona de hendidura gingival o en los espacios que rodean los dientes.
La dieta resulta también importante para el establecimiento y desarrollo de los microorganismos. El tipo de carbohidratos ingeridos y su cantidad pueden afectar el crecimiento de las poblaciones de estreptococos y lactobacilos bucales.
En otros casos, la flora bucal puede competir con microorganismos patógenos, como es el caso de la Cándida albicans que es un habitante frecuente de la boca y que cuando hay disturbios de la flora bacteriana puede provocar procesos patológicos.
Microorganismos de la flora bucal:
Las bacterias del género Lactobacillus se caracterizan por producir cantidades importantes de ácido láctico mediante la fermentación de carbohidratos simples.
De acuerdo a los productos finales obtenidos por la fermentación de la glucosa, los Lactobacillus han sido divididos en dos grupos:
- Homofermentativos: el ácido láctico es el mayor producto obtenido.
- Heterofermentativos: producen cerca de 50 por ciento de ácido láctico como producto final además de cantidades de dióxido de carbono, ácido acético y etanol.
Los principales Lactobacillus de aislamiento en la boca son:
- Lactobacillus acidophilus
- Lactobacillus casei
- Lactobacillus salivarius
- Lactobacillus plantarium
- Lactobacillus fermentum
- Lactobacillus allobiosus
- Lactobacillus brevis
Los Lactobacillus, como cualquier otro microorganismo, necesitan para su desarrollo un medio adecuado que le proporcione sus necesidades. En las bocas libres de caries generalmente no se encuentran Lactobacillus, sin embargo se ha demostrado que estos se localizan en determinadas áreas como en las fosas y fisuras, espacios interproximales y en los bordes gingivales.
En las bocas edentes, estas bacterias son muy bajas, pero cuando aparecen los dientes en los niños o cuando se ponen dientes artificiales en el adulto la cuenta de estos aumenta al igual que en las bocas con lesiones cariosas abiertas y en los sitios de retención de carbohidratos de la dieta.
Uno de los mayores productores de ácidos son los estreptococos, además de los Lactobacillus, Neisserias, estafilococos y levaduras.
8.1.2. Los estreptococos de la boca
Los Estreptococos viridans son las primeras bacterias que se establecen en la boca y permanecerán en ellas durante toda la vida como el grupo predominante de la flora permanente.
Se ha propuesto seis especies para el grupo viridans estas son:
- Estreptococos salivarius
- Estreptococos mutans
- Estreptococos pneumoniae
- Estreptococos milleri
- Estreptococos sanguis
- Estreptococos mitior
El Estreptococos Mutans se ha propuesto su división en cinco tipos diferentes atendiendo a sus diferencias fisiológicas. Estudios posteriores han clasificado los Estreptococos mutans en 8 serotipos diferentes.
8.2.-Respuesta inmune contra la placa dental:
La placa dental (PD) es una comunidad microbiana muy compleja formada por diferentes microorganismos, entre los que se destacan los cariogénicos y los relacionados con la enfermedad periodontal. En la PD se encuentran también componentes microbianos como los lipopolisacáridos, dextranos y ácidos lipoteicoicos que pueden tener efectos inmunopotenciadores o inmunosupresores sobre la respuesta inmune.
Para que se induzca una respuesta inmune por los componentes de la PD estos deben ser absorbidos por la encía, proceso en el que su tamaño o peso molecular es decisivo.
PARTE II. TEMAS DE INMUNOLOGÍA CLÍNICA
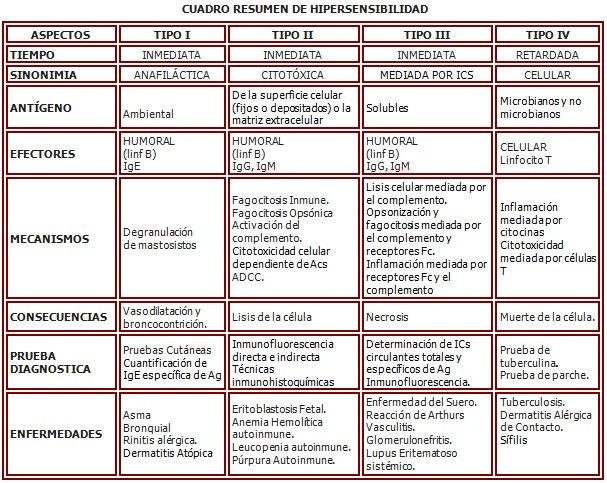
1. HIPERSENSIBILIDAD
La hipersensibilidad se define como una RI que produce daño tisular con repercusión histopatológica y clínica. Esta forma de RI tiene las características de poseer especificidad y memoria inmunológica, y ser de magnitud variable según la expresión individual del SI.
Es una inflamación que no se produce por la acción directa de agentes biológicos, químicos o físicos sobre el organismo, sino que son las células y las moléculas efectoras de la respuesta inmune y otras que pertenecen a los mecanismos inespecíficos de defensa quienes provocan el daño de los tejidos.
1.1. Clasificación:
Según el tiempo de aparición de las manifestaciones después del segundo contacto con el antígeno:
- Inmediatas: Las manifestaciones aparecen ante de transcurridas 24 horas de contacto desencadenante con el Ag y están relacionadas con la presencia de Acs.
- Retardadas: las manifestaciones aparecen después de 24 horas del contacto desencadenante con el Ag y están relacionadas con la presencia de linfocitos T específicamente sensibilizados.
Según el tipo de célula que interviene
- Humoral: mediada por el linfocito B
- Celular: mediada por el Linfocito T
Según el mecanismo inmunopatológico:
- Hipersensibilidad tipo I o anafiláctica.
- Hipersensibilidad tipo II o citotóxica.
- Hipersensibilidad tipo III o por inmunocomplejos.
- Hipersensibilidad tipo IV o celular.
1.2. Hipersensibilidad tipo I:
Las reacciones de hipersensibilidad de tipo I son causadas por RI a Ags medioambientales comunes, teniendo como efectores protagonistas las células TH2 (productoras de IL-4, IL-5 e IL-13), la IgE, los mastocitos y los eosinófilos; siendo los macrófagos y neutrófilos otros efectores secundarios de importancia significativa.
Los efectos patológicos mediados por estas células ocurren antes de las 24 horas, motivo por el cual a estas reacciones se le llaman hipersensibilidad inmediata. Los Ags medioambientales que generan típicamente RI alérgicas en individuos susceptibles son llamados alérgenos.
Las reacciones clínicamente adversas a Ags medioambientales, mediadas por RI adaptativas marcadas fenotípicamente por la presencia de IgE específica de alérgeno, junto con reclutamiento y activación de eosinófilos, mastocitos y células TH2 se denominan Alergia. Atopia se refiere a la susceptibilidad genética a desarrollar reacciones de hipersensibilidad inmediata a alergenos medioambientales.
Las reacciones de hipersensibilidad inmediata, ocurren en dos fases: la primera es la fase de sensibilización, y la segunda es la fase de desencadenamiento. La fase de sensibilización no es más que una RI primaria a un alérgeno en un individuo atópico; mientras que la fase de desencadenamiento constituye una RI secundaria (de memoria) al mismo alérgeno.
1.2.1. La secuencia típica de eventos en la fase de sensibilización es como sigue:
- Primera exposición al alérgeno.
- Activación de células T colaboradoras foliculares y estimulación del cambio de clase a IgE en las células B específicas del alérgeno.
- Producción de IgE.
- Unión de la IgE a su receptor Fc de alta afinidad correspondiente sobre los mastocitos, proceso llamado “sensibilización”.
1.2.2. La secuencia típica de eventos en la fase de desencadenamiento es como sigue:
- Exposición repetida al alérgeno.
- Activación de mastocitos (en tejidos) y basófilos (circulantes) con la consiguiente liberación de los mediadores responsables de los efectos patológicos.
1.2.3. Los mediadores químicos liberados por los mastocitos y basófilos pueden ser de dos tipos:
- Mediadores preformados o primarios: son los mediadores existentes en los gránulos antes del contacto desencadenante, e incluyen aminas biógenas, proteoglicanos y enzimas. Son los responsables de la reacción inmediata de la fase de desencadenamiento, cuya expresión clínica obedecen a cambios vasculares, por ejemplo, durante las reacciones cutáneas se observa eritema y edema (pápula) debido a la vasodilatación y el aumento de la permeabilidad vascular respectivamente. Igualmente contribuyen al daño tisular.
Mediadores de nueva síntesis o secundarios: son aquellos que comienzan a sintetizarse rápidamente luego de la activación celular, e incluyen los mediadores lipídicos como las prostaglandinas, leucotrienos, factor de activación de plaquetas y las citocinas como IL-1, IL-4, IL-5, IL-6, IL-13, GM-CSF, TNF. Son los responsables de la reacción tardía de la fase de desencadenamiento, que consiste exclusivamente en inflamación y reparación del tejido dañado.
Los fenómenos de hipersensibilidad tipo I pueden producirse por inhalación, de polvo de la casa, los ácaros el polen, pelo de animales, picaduras de insectos, ingestión de determinados alimentos, empleo de algunos medicamentos, etc.
Según la localización de donde ocurren estas reacciones, las mismas pueden ser locales o generales, dependiendo del tipo de inmunógeno, la vía de ingreso al organismo y la dosis.
1. Locales: Las reacciones locales dependen de la puerta de entrada del alérgeno. Se producen generalmente por inhalación, ingestión o contacto de la piel con el alérgeno. Rinitis, Asma, Dermatitis, etc
2. Generalizadas: La reacción es sistémica. Puede producirse tras la inyección intravenosa de un alérgeno frente a un huésped ya sensibilizado. Aparece el estado de shock minutos después de la inyección y a veces resulta mortal ejemplo: shock anafiláctico por penicilina)
1.2.4. Ejemplo de enfermedad:
- Asma bronquial: Enfermedad inflamatoria crónica de las vías aéreas, con ataques de tos, disnea y sibilantes. El órgano diana es el pulmón y en específico los bronquios.
1.3. Hipersensibilidad tipo II:
La hipersensibilidad II está mediada por Acs dirigidos contra Ags existentes en la superficie de las células o en la matriz extracelular. Las lesiones son debidas a la unión de Acs específicos a Ags tisulares fijos o células circulantes, y no al depósito de ICs formados en la circulación. En la mayoría de los casos dichos Acs son autoAcs, aunque ocasionalmente pueden producirse Acs contra Ags extraños que se depositan en la superficie de células circulantes o de los tejidos propios. Dichos Acs pueden ser de clase IgM o IgG, y ellos causan enfermedad al activar diferentes mecanismos efectores.
1.3.1. Mecanismos efectores de daño tisular mediado por Acs y de trastornos funcionales:
En las reacciones inmunológicas normales, las funciones protectoras de los Acs son mediadas por neutralización del Ag, activación del sistema del complemento y reclutamiento de células inflamatorias del hospedero. Los mismos mecanismos efectores son responsables de las consecuencias patológicas de este tipo de reacción.
1.3.2. Mecanismos:
1. Lisis de células, mediada por el complemento.
2. Lisis de células recubiertas de Acs, mediada predominantemente por células NK, proceso llamado citotoxicidad celular dependiente de Acs.
3. Opsonización y fagocitosis de células recubiertas de Acs.
4. Inflamación mediada por los receptores Fc de las Igs y productos del complemento.
5. Los Acs pueden causar trastornos funcionales de las células sin daño celular o hístico, proceso llamado disfunción celular.
1.3.3. Ejemplo de enfermedades:
-
Anemia hemolítica autoinmunitaria: el daño de los hematíes se realiza por autoAcs, que reaccionan con varios Ags dianas de la superficie de los hematíes. El Ac puede ser de clase IgG o IgM, y puede ser detectado en la superficie del hematíe por la prueba de la antiglobulina (prueba de Coombs). Cuando está presente en bajas concentraciones en la superficie celular, la IgG puede tener o no efecto. En concentraciones más altas ella lleva a la unión del hematíe a los macrófagos, los que tienen receptores para el Fc de la IgG; esta unión puede conducir al daño de la membrana del hematíe y a su fagocitosis y destrucción por los macrófagos.
-
Púrpura trombocitopénica autoinmune: los Ags dianas son componentes de la membrana plaquetaria, y las plaquetas igualmente sufren las mismas consecuencias que los eritrocitos en la anemia hemolítica autoinmunitaria.
-
Enfermedad de Graves Basedow (los Acs contra los receptores de la hormona estimulante del tiroides (TSH) mimetizan la acción de la misma y producen hiperfunción tiroidea).
1.4. Hipersensibilidad tipo III:
La hipersensibilidad tipo III, está mediada por ICs (compuestos de un Ag soluble y un Ac específico), donde el Ag puede ser extraño o propio, y casi siempre es circulante; de modo que los ICs pueden depositarse en las paredes de los vasos sanguíneos de cualquier parte del cuerpo, por tanto, en la práctica médica las enfermedades causadas por este tipo de reacción tienden a ser predominantemente sistémicas y afectan múltiples tejidos y órganos. Los Acs que inducen este tipo de reacción pueden ser IgM o IgG. Las características patológicas de estas enfermedades reflejan el o los sitios de deposición de ICs circulantes y no son determinadas por la fuente celular del Ag.
1.4.1. Mecanismos efectores de daño celular mediado por ICs:
1. Lisis de células mediada por el complemento.
2. Reclutamiento y activación de células inflamatorias (neutrófilos y macrófagos predominantemente) mediada por receptores Fc de las Igs y el complemento.
3. Opsonización y fagocitosis de células recubiertas de Acs.
4. Lisis de células recubiertas de Acs mediada predominantemente por células NK, proceso llamado citotoxicidad celular dependiente de Acs.
1.4.2. Ejemplo de enfermedades:
-
Reacción de Arthus.
-
Enfermedad del suero.
-
Vasculitis primarias mediadas por ICs.
-
Lupus eritematoso sistémico (LES).
1.4.3. Hallazgos morfológicos de daño tisular en la hipersensibilidad tipo III:
1. Necrosis. Contiene fibrina debido a la salida de proteínas plasmáticas (necrosis fibrinoide).
2. Infiltrados celulares compuestos predominantemente de neutrófilos. Por inmunofluorescencia se pueden detectar depósitos de Acs, componentes del complemento y moléculas de Ag.
1.5. Hipersensibilidad tipo IV:
Está mediada por los linfocitos T específicamente sensibilizados que promueven la inflamación o matan directamente células dianas. La inflamación es inducida principalmente por citocinas derivadas de los linfocitos T CD4+ de los subgrupos TH1 y TH17 que secretan citocinas que reclutan y activan leucocitos, y en menor medida también por citocinas derivadas de los linfocitos T CD8+ CTL. En algunos trastornos mediados por células T, los linfocitos T CD8+ CTL matan células del hospedero. Los Ags dianas en este tipo de reacción pueden ser propios o extraños localizados en la superficie de células propias. Con mucha frecuencia las RI protectoras fuertes contra microorganismos persistentes, especialmente microorganismos intracelulares resistentes a la eliminación por Acs y fagocitos, se acompañan de daño tisular mediado por células T.
1.5.1 Hipersensibilidad retardada:
Ejemplo característico para uso diagnóstico, es la reacción a la tuberculina. Se aplica a la piel o se inyecta por vía intradérmica una pequeña cantidad de t tuberculina. La respuesta característica aparece sobre las 12-48 horas y persiste por 48 horas o más. La piel se enrojece y aparece un nódulo firme central. En un individuo muy sensibilizado puede producirse necrosis y ulceración.
Microscópicamente, las características principales son la congestión de los pequeños vasos sanguíneos, acúmulos de linfocitos dentro y alrededor de los capilares y vénulas, infiltrado intenso de linfocitos y macrófagos.
El granuloma: formado por un agregado microscópico de células epitelioides (macrófagos acumulados transformados morfológicamente a células de aspecto epitelial) generalmente rodeadas por una corona de linfocitos. Patrón característico de la hipersensibilidad tipo IV.
Las reacciones de hipersensibilidad IV como otros tipos de inmunidad específica, constan de 3 procesos secuenciales:
1. Fase de reconocimiento: células T CD4+ o CD8 reconocen Ags proteicos extraños presentados sobre APC.
2. Fase de activación: los linfocitos T se activan, proliferan y se diferencian en células efectoras CD4+ TH1 y TH17, y CD8+ CTL.
3. Fase efectora:
a) Inflamación: las células efectoras migran hacia el sitio dañado, reconocen el Ag diana en condiciones adecuadas, se activan y secretan citocinas que reclutan y activan leucocitos circulantes en el sitio local de contacto con el Ag.
b) Daño tisular y reparación: los distintos mediadores secretados al espacio extracelular por los macrófagos y otros leucocitos inicialmente dañan el tejido circundante, y luego en fases posteriores de la misma reacción lo reparan de modo anómalo (reparación granulomatosa); y como consecuencia de este tipo de reparación quedan secuelas estructurales y funcionales.
2. ENFERMEDADES INFLAMATORIAS DE LA CAVIDAD BUCAL QUE INVOLUCRAN MECANISMOS INMUNOLÓGICOS
2.1-Por hipersensibilidad o inmunodeficiencia:
-
Caries dental.
-
Enfermedad periodontal crónica infecciosas. Gingivitis. Periodontitis
-
GUNA.
-
Periodontitis por medicamento.
-
Periodontitis juvenil.
2.2.-Enfermedad autoinmune:
-
Enfermedad mucocutánea. Gingivitis.
-
Enfermedades reumáticas. Síndrome Sjogren.
2.3.-Tumores:
-
Lesiones precancerosas.
-
Neoplasias malignas.
3.-CARIES DENTAL
La caries dental es una enfermedad multifactorial en la que influyen fundamentalmente tres factores y en el que el factor dependiente del hospedero, la respuesta inmune, puede jugar un papel muy importante frente a los microorganismos causantes de la carie dental.
-
Es una enfermedad infecciosa de la cavidad bucal.
-
De tipo bacteriana.
-
Con destrucción de la estructura ósea del diente por un proceso que afecta a los componentes orgánicos y minerales. Esmalte y dentina.
-
En relación al Estreptococo Mutans.
-
Relacionada con aumento de la PDB; se fabrica Dextrán
-
Interviene la enzima glucosiltransferasa.
3.1. Respuesta inmune en las caries dentales:
El Estreptococo Mutans, es el microorganismo cariogénico más estudiado y presenta varios componentes en su pared celular que pueden estimular la respuesta inmune del hospedero, entre ellos tenemos:
-
Glucanos.
-
Ácidos lipoteicoicos.
-
Glucosiltransferasa.
-
Polisacárido C.
-
Proteínas I,II,III,I/II
Para que la respuesta inmune pueda efectuar su acción protectora tiene que llegar al lugar donde se produce la caries dental y será diferente según la localización de la lesión. Así la protección frente a las caries que se desarrollen en el dominio salival dependerá de la acción de la IgA, que puede inhibir la adhesión de los microorganismos a la superficie dental e inhibir la acción de la glucosiltransferasa, mientras la protección frente a las caries que se desarrollen en el dominio gingival dependerá de la acción de la IgM e IgG que además de inhibir la adhesión de los microorganismos a la superficie dental e inhibir la acción de la glucosiltransferasa pueden aglutinar y opsonizar los microorganismos que serán fagocitados por los fagocitos presentes en el líquido gingival.
En la respuesta inmune contra el Estreptococo Mutans intervienen dos tipos de factores:
-
La colonización materna: una alta colonización materna puede facilitar el desarrollo de una respuesta protectora en el hijo.
-
Los factores genéticos:
3.2. Factores que facilitan el desarrollo de las caries dentales:
-
Baja inmunogenicidad del Estreptococo Mutans.
-
La estimulación antigénica en el sistema inmune asociado a las mucosas (MALT) puede no ser suficientemente intensa para desarrollar una respuesta inmune protectora.
-
Factores genéticos.
3.3. Tratamiento:
-
Higiene bucal. Para disminuir la PDB. Cepillado.
-
Fluoruros. Para dar resistencia al diente.
-
Disminución de carbohidratos fermentados en la dieta.
-
Protección del esmalte del diente por Acs del líquido del surco gingival.
-
Uso de antibióticos.
-
Inmunización con Ags.
-
Uso de Acs monoclonales contra Estreptococo Mutans.
4. GINGIVITIS Y PERIODONTITIS
4.1.-Consideraciones generales:
Es la inflamación de los tejidos de apoyo de los dientes. La gingivitis es la enfermedad inflamatoria que afecta la encía, y la periodontitis es la enfermedad inflamatoria que afecta el ligamento periodontal y al hueso alveolar que rodea y sostienen al diente. La placa dental bacteriana (PDB) está compuesta de una masa de bacterias que se adhieren de forma tenaz a la superficie del diente, con actividad proteolítica y citotóxica. En la PDB la inserción entre la encía y los dientes se ha perdido y se forma una placa subgingival bacteriana sobre las superficies radiculares y la pérdida ósea es clínicamente aparente. La PDB tiene una microflora compleja con bacterias, bacilos Gram positivos y Gram negativos.
4.1. Bacterias que se relacionan:
-
Estreptococos.
-
Actinomyces.
-
Hemofhilus.
-
Espiroquetas.
4.2. Bacilos que se relacionan:
-
Bacteroides gingivales.
-
Bacteroides melaninogenicus.
-
Fusobacterium Nucleatum.
-
Más de 50 % bacilos y espiroquetas.
4.3. Clasificación:
Aguda:
-
Es una enfermedad inflamatoria de la encía.
-
Producida por acumulación de placa dental adyacente a la encía inflamada.
-
La encía se caracteriza por tener un color rojo oscuro.
-
Ocurre sangrado después del cepillado o del sondeo.
-
Se presenta un exudado según la gravedad del proceso.
Crónica:
-
Se produce fibrosis gingival.
-
Con destrucción del ligamento periodontal.
-
Acompañado de destrucción del hueso alveolar.
-
Formación de bolsas por desprendimiento de la encía del diente.
4.4 Enfermedad periodontal inflamatoria crónica. (EPIC):
-
Es la enfermedad inflamatoria de la encía, del ligamento peridontal y del hueso alveolar.
-
Hay destrucción y formación de bolsas en la encía.
-
Los dientes se aflojan.
-
Puede ocurrir la pérdida total.
4.5. Características inmunológicas:
-
La placa dental bacteriana induce inflamación de los tejidos que rodean íntimamente los dientes.
-
Las respuestas locales del huésped no son efectivas en la eliminación de las bacterias que continúan adhiriéndose a las superficies dentales.
-
Las respuestas locales incluyen la activación del complemento, infiltración de leucocitos, liberación de enzimas lisosómicas y citocinas y la producción del exudado seroso en el surco gingival.
-
Se involucran tanto la inmunidad humoral como la celular.
-
El Ag inflamatorio de las bacterias y las reacciones inmunológicas del huésped provocan la enfermedad.
-
El exudado se caracteriza por ser seroso, líquido de resquicio gingival, contiene componentes del complemento y cifras bajas de IgG.
4.6. Patogénesis:
4.6.1. Mecanismos destructores:
-
Efecto directo de la PDB.
-
Lesión inducida por los PMN neutrófilos.
-
Lesión mediada por el complemento, que incluye el complemento activado por la vía clásica y alternativa (activadores: endotoxinas como el péptidoglicanos, lipopolisacáridos, etc.).
-
Lesión mediada por células (linfocitos T).
4.6.2. Mecanismo inmunológico:
-
Activación del complemento por la vía clásica (IgG e IgM contra Ags de la PDB).
-
Activación del complemento por la vía alternativa por endotoxinas bacterianas (péptidoglicanos y otros), con participación de enzimas proteolíticas (colagenasa y triptasa).
-
Inflamación mediada por el complemento, siendo los productos C3a y C5a los factores quimiotácticos y activadores de PMN, y participantes indirectos en la formación del edema y el exudado.
-
Activación de linfocitos T y B contra Ags de la PDB.
-
Presencia de linfoquinas que facilitan la destrucción ósea (Factor activador de osteoclastos).
4.7. Respuesta inmune en la enfermedad periodontal:
La EPIC es un proceso que afecta inicialmente a la encía produciendo gingivitis y posteriormente a los tejidos que soportan el diente: tejido conectivo de soporte, ligamento periodontal y hueso alveolar.
La gingivitis es un proceso reversible si se elimina la PDB los mecanismos inmunológicos efectores van dirigidos a contener la entrada de los productos de la PD en la encía y se basan en la actuación de los Acs, con neutralización de enzimas, activación del complemento (quimiotaxis e inflamación y la fagocitosis (eliminación de productos microbianos).
En el desarrollo de la periodontitis del adulto son muy importantes los mecanismos inmunológicos. Se han descrito cuatro etapas.
-Lesión inicial:
Básicamente es una gingivitis y es reversible si se elimina la placa. La inflamación se produce por la activación del complemento, que está facilitada por la presencia de Acs frente a los microorganismos de la placa. Los factores quimiotácticos atraen PMN a la encía.
-Lesión temprana:
Todavía reversible. Comienzan a acumularse Linfocitos, la mayoría LT que liberan citocinas.
Poca acumulación de células plasmáticas.
-Lesión establecida:
Es un proceso crónico que se caracteriza por la acumulación de células plasmáticas que producen IgG. Comienza a formarse la bolsa gingival.
-Lesión avanzada:
Se produce un cambio de la lesión establecida de carácter crónico a un proceso autodestructivo.
Los mecanismos relacionados con el daño celular se basan en la acción directa de las enzimas microbianas (proteasas, colagenasas, hialuronidasas y leucotoxina) y a mecanismos inmunopatológicos estimulados por el lipopolisacárido de las bacterias Gram negativas y mediados por citocinas y prostraglandinas.
4.8. Diagnóstico inmunológico:
-
Cifras de Acs séricos o salivales: normales.
-
Presencia de Acs y LT contra Ags de la PDB.
4.9. Tratamiento y pronóstico:
-
Higiene Bucal. Disminuir la PDB. Cepillado.
-
Antibióticos?
-
Cirugía periodontal
5.-GINGIVITIS ÚLCERONECRONIZANTE AGUDA (GUNA)
Las enfermedades gingivales y periodontales están catalogadas entre las afecciones más comunes del género humano. La gingivitis afecta aproximadamente al 80 % de los niños de edad escolar y más de 70 % de la población adulta ha padecido gingivitis, periodontitis o ambas. Los resultados de investigaciones y estudios clínicos revelan que las lesiones producidas por las periodontopatías en las estructuras de soporte de los dientes en los adultos jóvenes son irreparables, y que en la tercera edad destruye gran parte de la dentadura natural, privando a muchas personas de todos sus dientes durante la vejez. Factores de riesgo como el tabaquismo, estrés, diabetes mellitus, bruxismo, prótesis mal ajustadas, factor socioeconómico, nivel de instrucción, dietas, estilo de vida y muchos otros, interactuando entre sí, se asocian con el origen y evolución de las enfermedades que afectan el periodonto, así como de las urgencias periodontales, como la GUNA.
La gingivitis úlceronecronizante aguda (GUNA) se caracteriza por ser un proceso inflamatorio agudo destructivo del periodonto, que puede afectar tanto la encía marginal, papilar, y en menor grado y frecuencia, la encía adherida, el cual conduce a una necrosis del epitelio y del tejido conectivo, y presenta síntomas y signos característicos.
La GUNA se caracteriza por aparición repentina, de forma frecuente después de una enfermedad debilitante o infección respiratoria aguda, la modificación de los hábitos de vida, trabajo intenso sin descanso adecuado y la tensión psicológica son elementos que con frecuencia se observan en estos pacientes.
En países subdesarrollados como los de África, es frecuente, y se presenta en sus cuadros clínicos más graves. Lo mismo sucede en pacientes portadores del síndrome de inmunodeficiencia adquirida (sida).
5.1. Clasificación:
Con mayor frecuencia la GUNA se presenta como una enfermedad aguda. Su forma relativamente más leve y persistente se denomina subaguda. La enfermedad recurrente se caracteriza por períodos de remisión y exacerbación. En la actualidad se reconocen lesiones úlceronecrotizantes crónicas en pacientes con inmunodeficiencias marcadas como en los casos de sida aceptadas en las nuevas clasificaciones de enfermedad periodontal como la Periodontitis Úlceronecrotizante (PUN).
5.2. Características epidemiológicas:
Generalmente se presenta en adolescentes y adultos jóvenes especialmente entre 15 y 30 años de edad, aunque puede aparecer a cualquier edad. Es rara en pacientes mayores de 50 años. Puede presentarse en niños particularmente mal nutridos e inmunodeprimidos. No hay diferencias en cuanto al sexo. Se señala que la enfermedad no es transmisible ya que la transferencia experimental de microorganismos de lesiones activas a individuos sanos no inicia la enfermedad. El hallazgo de GUNA en grupos que hacen vida común se asocia a factores como tensiones emocionales y otros medioambientales pero no al posible contagio.
5.3. Características histopatológicas
El aspecto histopatológico de la GUNA corresponde a un proceso necrotizante agudo no específico que compromete tanto el epitelio como el tejido conectivo. Cuadros similares pueden observarse en casos de trauma o irritación química tras la aplicación de agentes cáusticos, por ejemplo.
El epitelio superficial aparece destruido y reemplazado por una trama pseudomembranosa de fibrina, células epiteliales necróticas, leucocitos polimorfonucleares y varias clases de microorganismos. Esta zona se corresponde clínicamente con la pseudomembrana superficial.
Por debajo de esta pseudomembrana, el tejido conectivo está hiperémico y presenta numerosos capilares ingurgitados y un infiltrado denso de leucocitos polimorfonucleares hacia la superficie, con otras células inflamatorias en las capas profundas.
Se observa una mezcla gradual de la encía sana con la encía necrótica. El epitelio cercano a las zonas de ulceración puede presentar infiltrado leucocitario entre las células, aun con borramiento de algunas de sus capas, lo mismo que edema intracelular y degeneración hidrópica.
La inflamación en el tejido conectivo va disminuyendo gradualmente a medida que se aleja de la lesión necrótica, hasta que su aspecto se identifica con el estroma del tejido conectivo sano de la gíngiva normal.
5.4. Características microbiológicas e inmunológicas:
La flora microbiológica que originalmente se asocia a la GUNA se describe como un complejo fusoespiroquetal. La ayuda de la microscopía de campo oscuro y el microscopio electrónico así como el uso de técnicas inmunológicas ha permitido reconocer un número determinado de bacterias representativas. Como por ejemplo: treponemas, fusobacterias entre otras.
Se considera que el complejo bacteriano actúa como un patógeno oportunista que se aprovecha de períodos en los que los mecanismos de defensa del huésped están comprometidos para dar lugar a un sobrecrecimiento e invasión bacteriana.
5.5. Las zonas en GUNA:
Se han descrito cuatro zonas en los casos de GUNA, desde la parte superficial a la profundidad.
Zona bacteriana: es la más superficial. Consistente en masa de bacterias de diversas formas y tamaño, incluyendo unas pocas espiroquetas.
Zona rica en neutrófilos: por debajo de la bacteriana, caracterizada por el predominio de neutrófilos. Aparecen entre los leucocitos otros microorganismos entre los cuales se encuentran las espiroquetas.
Zona de necrosis: contiene células en período de desintegración, espiroquetas de los tipos largos o medios y otras bacterias compatibles en tamaño y apariencia con elementos fusiformes.
Zona de infiltración espiroquetal: los tejidos aparecen sanos pero infiltrados por espiroquetas de tipo intermedio y largo. No se aprecian otros microorganismos en esta área.
5.6. Características imagenológicas:
No se producen cambios radiográficos, ya que la GUNA afecta solamente tejidos blandos. Se aprecian cambios radiográficos cuando la enfermedad se sobreañade a un proceso que ya ha interesado el periodonto de inserción (periodontitis), pero la imagen se debe a la afección previa, o también cuando se produce una variante de la enfermedad a modo de periodontitis úlcero-necrotizante aguda (PUN).
5.7. Cuadro clínico:
Síntomas bucales: las lesiones son muy sensibles al tacto y el paciente se queja de un dolor constante, irradiado, corrosivo, que se intensifica al contacto con alimentos condimentados o calientes y con la masticación. Es este el síntoma más común y una de las causas más frecuentes de que el paciente acuda a consulta. Presenta en la boca un sabor metálico desagradable y el paciente tiene conciencia de tener cantidad excesiva de saliva pastosa. Se describe una sensación característica de dientes como estacas de madera.
Tanto el sangrado como el dolor están en relación con el nivel de destrucción tisular y se deben a la falta de acción protectora del epitelio, ya que al desparecer este, los vasos sanguíneos y las terminaciones nerviosas de la dermis quedan expuestos al medio bucal.
Signos bucales: las lesiones características son depresiones crateriformes socavadas en la cresta de la encía que abarcan la papila interdental, las encías marginales o ambas. La superficie de los cráteres gingivales está cubierta por una pseudomembrana gris, separada del resto de la mucosa gingival por una línea eritematosa definida. En algunos casos, quedan sin la pseudomembrana superficial y exponen el margen gingival, que es rojo, brillante y hemorrágico. Las lesiones características destruyen progresivamente la encía y los tejidos periodontales subyacentes.
El olor fétido, el aumento de la salivación y la hemorragia gingival espontánea o hemorragia abundante ante el estímulo más leve son otros signos clínicos característicos.
La GUNA se produce en bocas sanas o sobreañadidas a afecciones gingivales o periodontales crónicas. La lesión puede circunscribirse a un solo diente, a un grupo de dientes o abarcar toda la boca. Es rara en pacientes desdentados, pero a veces se producen lesiones esféricas aisladas en el paladar blando.
Signos extrabucales y sistémicos: los pacientes, por lo general, son ambulatorios, con un mínimo de complicaciones sistémicas: linfoadenopatía local y aumento leve de temperatura (febrícula), son características comunes de los estadios leve y moderado de la enfermedad. En los casos graves son complicaciones orgánicas marcadas como la fiebre alta, pulso acelerado, leucocitosis, pérdida del apetito y decaimiento general. Las reacciones generales son más intensas en niños y pacientes inmunodeprimidos.
5.8 Evolución:
La evolución clínica es indefinida. Si no se realiza tratamiento, puede tener por consecuencia destrucción progresiva del periodonto y denudación de las raíces, junto con intensificación de las complicaciones tóxicas sistémicas en dependencia del estado inmunológico del paciente. Muchas veces su intensidad decrece y desemboca en un estado subagudo con diversos grados de sintomatología clínica. Estos pacientes suelen presentar antecedentes de remisiones y exacerbaciones repetidas. También puede observarse la repetición de la afección en pacientes ya tratados.
En casos más avanzados las lesiones necróticas pueden llegar a la encía adherida y se describe que en pacientes con una resistencia muy pobre asociada con malnutrición grave u otras deficiencias inmunológicas, la necrosis gingival puede avanzar hacia la apófisis alveolar y exponerla.
5.9. Diagnóstico:
El diagnóstico se basa en la historia de la enfermedad y los hallazgos clínicos. Los estudios bacteriológicos son útiles para el diagnóstico diferencial. El examen microscópico de los tejidos biopsiados tampoco es suficientemente específico para aportar al diagnóstico.
5.10. Diagnóstico diferencial:
-
Difteria.
-
Candidiasis.
-
Actinomicosis.
-
Gingivitis herpética aguda.
-
Gingivo-estomatitis estreptocócica.
-
Estomatitis gonocócica.
-
Agranulocitosis.
-
Angina de Vincent.
-
Gingivitis descamativa.
5.11. Pronóstico:
Por lo general es favorable siempre que se diagnostique correctamente, sin embargo existen algunos factores que pueden influir como:
-
Grado de afección.
-
Tiempo de evolución.
-
Cooperación del paciente.
-
Estado físico y nutricional.
-
Estado psíquico del paciente.
-
Tabaquismo.
5.12. Tratamiento:
El tratamiento de la GUNA consiste fundamentalmente en el alivio de los síntomas agudos, constituye una urgencia y debe atenderse en el nivel primario de atención. Se han descrito cuatro fases en el tratamiento de esta afección.
5.12.1. Primera fase:
En la misma nos dirigimos fundamentalmente al alivio de los síntomas agudos (bucales y generales).
En esta primera visita podemos eliminar muy suavemente, con una torunda de algodón embebida en agua oxigenada la pseudomembrana y los residuos superficiales y no adheridos. Deben evitarse movimientos de barrido en zonas amplias con una sola torunda.
Algunos autores indican que se comiencen a eliminar los cálculos superficiales en esta visita, aplicando anestesia tópica y preferentemente con el instrumental ultrasónico, sin embargo otros no lo recomiendan pues favorece la toxemia y la bacteriemia.
Todo tratamiento quirúrgico está contraindicado en este momento.
Indicaciones:
-
Se indica al paciente enjuagatorios con sustancias oxigenantes.
-
Indicamos analgésicos para el dolor, aunque generalmente el mismo remite a las pocas horas de iniciado el tratamiento.
-
Se orienta evitar el tabaco, el alcohol y los condimentos.
-
Proseguir sus actividades habituales (según el estado general), pero evitar el ejercicio físico prolongado y exposición al sol.
-
Si el paciente está sometido a tensiones nerviosas debe aconsejarse medidas de higiene mental.
-
Aunque se indica mantener el cepillado debe limitarse en los primeros momentos a la eliminación de residuos superficiales.
-
El cepillo dental debe guardarse en un lugar aireado.
-
De existir fiebre indicar antipirético.
-
Se sugiere tratamiento antibiótico.
MNT:
-
Fitofármacos: colutorios de manzanilla, caléndula, llantén.
-
Ozonoterapia: aplicación de aceite ozonizado.
Se cita nuevamente entre las 24 y 48 horas.
5.12.2. Segunda fase:
De ser favorable la evolución, podemos comenzar la eliminación del cálculo dentario e insistir en la realización correcta del cepillado dentogingival.
Se cita de nuevo a las 72 horas o una semana según evolución.
5.12.3. Tercera fase:
Se termina la eliminación del cálculo dentario.
Se insiste en los procedimientos de control de placa dentobacteriana.
Se valora la suspensión de los medicamentos.
Si no hay secuelas se puede valorar el alta.
De existir enfermedad periodontal crónica subyacente o mantenerse la pérdida de la morfología general, se realiza el tratamiento de las mismas.
Se recomienda no realizar ningún tipo de tratamiento quirúrgico hasta cuatro semanas después de haber cesado la fase 1.
5.13. GUNA y síndrome de inmunodeficiencia adquirida (sida):
La GUNA puede aparecer en conjunción con el sida. Es posible diagnosticar presuntivamente casos de infección por VIH basándonos en la presencia recurrente de este tipo de gingivitis.
La periodontitis úlceronecronizante, (PUN) podría ser considerada una GUNA que ha aumentado su gravedad, se presenta en pacientes con marcado deterioro inmunitario y puede ser un hallazgo más frecuente en pacientes con SIDA.
La frecuencia de PUN entre los pacientes VIH (positivo) oscila entre el 1 y el 10 %, es más frecuente en varones homosexuales. La PUN es altamente predictiva de diagnóstico de SIDA y es un signo precoz de deterioro inmunitario. La PUN asociada con un diagnóstico de sida es un marcador muy fiable de progresión rápida de VIH.
6. OTRAS AFECCIONES BUCALES
6.1. Hiperplasia gingival inducida por medicamentos. (Fenitoína):
La fenitoína altera la conductancia de sodio, potasio y calcio, los potenciales de membrana y las concentraciones de ciertos aminoácidos y los neurotransmisores acetilcolina y ácido gamma amino butírico. A concentraciones elevadas inhibe la liberación de serotonina y noradrenalina, promueve la recaptación de dopamina e inhibe la actividad de la enzima monoamino-oxidasa. La fenitoína afecta las cifras salivales y séricas de las Igs e induce cambios en las glándulas salivales. La hiperplasia gingival se produce por acumulación de la PDB secundaria a una respuesta local de los fibroblastos y células epiteliales.
- Periodontitis juvenil:
Aparece en individuos jóvenes donde se produce pérdida del hueso periodontal con gran rapidez. Puede tener una evolución de 2 a 5 años. La caracteriza la presencia de una flora anaeróbica y Gram negativa, y se plantea un posible defecto en la función de los granulocitos PMN.
- Estomatitis aftosa. Ulceración bucal recurrente:
6.3.1. Consideraciones generales:
Son enfermedades recurrentes, que pueden aparecer como entidades únicas de causa desconocida, o asociada a otras enfermedades sistémicas como el síndrome de Behcet o localizadas como la enfermedad celíaca. En su etiología intervienen factores emocionales, nutricionales y hormonales como el ciclo menstrual. Las causas más frecuentes son las infecciones; virales por el virus del herpes simple tipo I e infecciones bacterianas por el estreptococo. Igualmente se plantea una posible causa inmunopatológica donde los autoAgs de las células epiteliales superficiales de la mucosa bucal podrían desencadenar reacciones autoinmunes, motivo por los cuales pueden detectarse niveles de IgG y C3 elevados, y aumento de los linfocitos T. Se plantea una posible asociación con moléculas HLA B12.
6.3.2. Características clínicas:
Esta enfermedad se caracteriza por úlceras bucales recurrentes y dolorosas, cubiertas por membrana gris rodeada de un anillo eritematoso, que pueden aparecer aisladas o en grupos, de tamaño variable, y en ocasiones confluyen dando el aspecto de racimos.
6.3.3. Características inmunológicas:
Hay presencia temprana de una infiltración linfocitaria con participación de la inmunidad celular. Con respecto a la inmunidad humoral, se observan Acs contra la mucosa bucal; y presencia de ICs circulantes. Asociación con HLA.
6.4. Enfermedades Sistémicas con manifestaciones de enfermedades bucales y mecanismos inmunológicos:
- Pénfico.
- Lupus eritematoso fijo discoide. (LEFD).
- Lupus eritematoso sistémico (LES).
- Eritema multiforme.
- Liquen plano.
- Sarcoidosis.
- Síndrome de Sjogren.
- Artritis reumatoidea.
- Candidiasis bucal.
7. INMUNODEFICIENCIAS
Varios factores determinan el resultado de las relaciones hospedero-huésped, pero uno de los más esenciales es la integridad del SI. Las inmunodeficiencias constituyen un grupo muy amplio de enfermedades en las que se demuestra un déficit cualitativo o cuantitativo en uno o más componentes del SI, así como en los mecanismos reguladores de las RI. Estas enfermedades son raras, graves y mortales.
Estas enfermedades son clasificadas en dos grandes grupos.
7.1.-Clasificación:
7.1.1. Inmunodeficiencias congénitas o primarias (IDP):
Las inmunodeficiencias congénitas o primarias (IDP), que comprenden más de 200 enfermedades hasta la fecha, son causadas por defectos genéticos con expresión clínica generalmente durante la infancia y niñez temprana, aunque pueden aparecer en edades más tardías de la vida.
7.1.2. Inmunodeficiencias adquiridas o secundarias (IDS):
Las IDS son un grupo de trastornos del SI donde no es demostrable anormalidades genéticas, sino que más bien se adquieren en la vida a consecuencia de otros trastornos que repercuten negativamente en la función del SI. Las IDS son causadas por un conjunto de mecanismos patogénicos: Secundarias a un grupo amplio de enfermedades, Como complicaciones de tratamientos inmunosupresores, las llamadas IDS iatrogénicas. Adquiridas por infecciones que atacan las células del SI. En este grupo el ejemplo más prominente es el síndrome de inmunodeficiencia adquirida (sida) causado por el virus de la inmunodeficiencia humana (VIH).
7.2. Características generales:
- Aunque son clínicamente muy heterogéneas, se manifiestan fundamentalmente por un aumento de la susceptibilidad a las infecciones. Otras manifestaciones no menos importantes son: infecciones graves por microorganismos de baja virulencia, evolución tórpida de infecciones por patógenos comunes e infecciones oportunistas. El espectro de las infecciones varía según el componente inmune afectado.
- Susceptibilidad a ciertos tipos de cánceres. Esta particularidad es predominantemente propia de las IDP celulares, y muchos tipos de cánceres asociados a estas IDP son causados por virus oncogénicos.
- Asociación con una incidencia incrementada a enfermedades autoinmunes (EAI). La asociación IDP-EAI, hasta la fecha pobremente comprendida, es bidireccional; o sea las IDP pueden generar EAI y viceversa.
7.3. Clasificación de las IDP:
El modo más práctico de clasificar las IDP es según el componente afectado, y en base a este se clasifican en:
1. Deficiencias de la inmunidad innata
a) Deficiencias del complemento
b) Deficiencias de los fagocitos
2. Deficiencias de la inmunidad adaptativa
a) Deficiencias de las células B
b) Deficiencias de las células T
c) Deficiencias combinadas de las células T y B
7.4. Deficiencias de la Inmunidad Innata:
7.4.1. Deficiencias del complemento:
Las deficiencias de proteínas del complemento y proteínas reguladoras son causas de varias enfermedades humanas. La deficiencia de C2 es la más frecuente de las deficiencias del complemento. Más del 50 % de pacientes con deficiencias de C1q, C2 y C4 desarrollan LES. Pacientes con deficiencia de C1q desarrolla edema angioneurótico hereditario (EAH). Las deficiencias de C3 están asociadas con infecciones bacterianas piógenas recurrentes y severas. En general, y con escasas excepciones, las deficiencias de proteínas reguladoras conducen a consumo excesivo de proteínas del complemento y susceptibilidad a las infecciones entre otros trastornos. Las deficiencias en las proteínas del MAC conducen a susceptibilidad infecciosa por bacterias del género de las neisserias.
7.4.2. Deficiencias de los fagocitos:
Las deficiencias de los fagocitos incluyen trastornos de los polimorfonucleares o los fagocitos mononucleares del linaje mieloide. Dentro de los granulocitos los más comúnmente afectados son los neutrófilos, mientras que los trastornos de los fagocitos mononucleares afecta a los monocitos, macrófagos o células dendríticas. Ejemplo de ellas:
- Neutropenia severa congénita (NSC): constituye el prototipo de defecto cuantitativo.
- Enfermedad granulomatosa crónica (EGC): constituye el prototipo de defecto cualitativo
7.5. Deficiencias de la inmunidad adaptativa:
Dentro de las deficiencias de la inmunidad adaptativa, las IDP humorales son considerablemente más frecuentes que las celulares. A continuación se exponen los aspectos más significativos de las IDP más comunes en la práctica médica, así como los prototipos de deficiencias cuantitativas.
7.5.1. Deficiencias de las células B:
7.5.1.1. Agammaglobulinemia ligada al cromosoma X:
- Esta enfermedad, también llamada agammaglobulinemia de Bruton, es causada por defectos en el gen que codifica una enzima llamada tirosina kinasa de Bruton, la cual es muy importante en la progresión de la maduración de los linfocitos B, de modo que los linfocitos B inmaduros no transitan por sus diferentes etapas madurativas y finalmente mueren por apoptosis.
- Esta anomalía se hereda con carácter recesivo ligada al sexo.
- Tiene una baja incidencia, de aproximadamente 1 en 200 000.
- De modo casi exclusivo, esta enfermedad se manifiesta después de los 4 a 8 meses de edad, etapa coincidente con la pérdida fisiológica de las Igs maternas transferidas por vía placentaria durante el segundo y tercer trimestre del embarazo.
- Los pacientes que sufren de esta enfermedad usualmente no producen, o producen cantidades muy bajas de todas las clases de Igs séricas; lo mismo ocurre con las Igs en las secreciones corporales (saliva, lágrimas y secreciones mucosales). El número y la función de las células T generalmente son normales.
- Entre sus principales manifestaciones clínicas se encuentran infecciones bacterianas recurrentes, especialmente por bacterias extracelulares; y en una proporción baja de pacientes aparecen manifestaciones autoinmunes.
7.5.1.2. Deficiencia selectiva de IgA (DSIgA):
- Es la IDP más común en la práctica médica.
- Afecta de 1 en 400 a 1 en 700 individuos según la población estudiada.
- Se caracteriza por niveles bajos de IgA sérica, con niveles normales o elevados del resto de IgG e IgM.
- Usualmente ocurre de forma esporádica, aunque se han confirmado muchos casos de familias con modelos de herencia autosómico dominante y autosómico recesivo.
- Tiene expresión clínica variable, que incluye pacientes completamente asintomáticos (aproximadamente 2/3 de los casos), otros presentan infecciones respiratorias y diarreas ocasionales; y raramente algunos pacientes sufren de infecciones recurrentes y severas que resultan en daño intestinal y de la vía aérea permanentes, con enfermedades autoinmunes asociadas.
- El defecto encontrado en estos pacientes es un bloqueo en la diferenciación de las células B a células plasmáticas secretoras de IgA. La inmunidad celular está intacta en la gran mayoría de los casos.
7.5.2. Deficiencias de las células T:
7.5.2.1. Síndrome de Di-George (SDG). Aplasia o hipoplasia tímica:
- Inicialmente considerado un trastorno esporádico raro, pero estudios recientes confirman algo diferente, con una incidencia que oscila desde 1 en 4000 a 1 en 6000 nacidos vivos.
- Afecta a ambos sexos por igual.
- El SDG se caracteriza clásicamente por una triada de rasgos clínicos: hipocalcemia debida a aplasia o hipoplasia de la glándula paratiroides, inmunodeficiencia secundaria a aplasia o hipoplasia del timo, y defectos cardiacos congénitos.
- La inmunodeficiencia vista en estos pacientes está dominada por la producción y función de las células T dañadas, con anormalidades secundarias ocasionales en la función de las células B. Sin embargo, el espectro de inmunodeficiencia es amplio, y va desde número y función de células T severamente dañadas con o sin repercusión de la función de las células B, hasta producción normal o discretamente disminuida de células T con función normal de los linfocitos B.
- En general el déficit de células T mejora durante el primer año de vida. Las consecuencias de la deficiencia de células T en pacientes con SDG son una susceptibilidad incrementada a las infecciones, particularmente virales y micóticas, y un riesgo incrementado de enfermedades autoinmunes.
- Las malformaciones cardiovasculares más comunes incluyen tronco arterioso, coartación del arco de la aorta y tetralogía de Fallot. Los pacientes están en riesgo de varias anormalidades de la glándula paratiroides, incluyendo hipoparatiroidismo latente, el cual puede evolucionar a hipoparatiroidismo hipocalcémico durante la niñez temprana o la adolescencia.
- Los recién nacidos o infantes con SDG pueden tener dismorfismo facial, con una o más de las siguientes alteraciones: hipertelorismo (ojos ampliamente separados), orejas prominentes y de inserción baja, micrognatia. Igualmente se han observado anormalidades del paladar como paladar hendido, paladar hendido submucoso, insuficiencia velofaríngea, úvula bífida, labio hendido o partido con o sin paladar hendido.
7.6. Inmunodeficiencias secundarias (IDS) o adquiridas:
7.6.1. Causas de IDS:
- Enfermedades genéticas: monosomía 22, trisomía 8, trisomía 21, sicklemia, fibrosis quística, etc.
- Enfermedades neoplásicas malignas: inmunodeficiencia con timoma (síndrome de Good), leucemia linfocítica crónica, neoplasias malignas de células B, síndrome mielodisplásico, linfoma No-Hodgkin, etc.
- Enfermedades metabólicas: diabetes mellitus, errores innatos del metabolismo, mal nutrición proteico-energética (causa más frecuente de IDS en el mundo), deficiencia de vitaminas y minerales, deficiencia de hierro, uremia, etc.
- Enfermedades infecciosas: malaria, rubeola congénita, sarampión, VIH, CMV congénito, toxoplasmosis congénita, infección con el VEB, influenza, etc.
- Enfermedades renales: insuficiencia renal crónica.
- Condiciones perdedoras de proteínas: enteropatías perdedoras de proteínas, síndrome nefrótico, linfangiectasia intestinal.
- Fármacos: esteroides, agentes antimaláricos, captopril, carbamazepina, valproatos, fenitoína, fenclofenaco, sales de oro, penicilamina, sulfasalazina, agentes antineoplásicos e inmunosupresores, agentes biológicos.
- Relacionadas con el estrés: trauma, cirugía, anestesia, quemaduras, ejercicio físico agotador prolongado, estrés psicológico prolongado.
- Embarazo.
- Exposición a la luz ultravioleta y radiaciones ionizantes.
- Edades extremas de la vida.
7.7. Características asociadas con las inmunodeficiencias que nos permiten establecer su diagnóstico:
7.7.1. Características frecuentemente presentes y altamente sospechosas:
- Infecciones crónicas.
- Infecciones recurrentes.
- Agentes infecciosos raros.
- Curación incompleta o respuesta incompleta al tratamiento.
7.7.2. Características que se presentan con frecuencia y que son moderadamente sospechosas:
- Erupción cutánea.
- Diarrea crónica.
- Incapacidad para crecer.
- Hepatoexplecnomegalia.
- Abscesos recurrentes.
- Osteomielitis recurrentes.
- Antecedentes de enfermedad autoinmune.
7.7.3. Características raras y asociadas con trastornos por inmunodeficiencias específicas:
- Eccema.
- Ataxia.
- Telangectasia.
- Enanismo con extremidades cortas.
- Endocrinopatías idiopáticas.
- Albinismo parcial.
8. INFECCIÓN CON EL VIRUS DE LA INMUNODEFICIENCIA HUMANA (VIH) Y SÍNDROME DE INMUNODEFICIENCIA ADQUIRIDA (SIDA)
El síndrome de inmunodeficiencia adquirida es el conjunto de manifestaciones clínicas que aparecen como consecuencia de la depresión del sistema inmunológico debido a la infección por el virus de la inmunodeficiencia humana (VIH). Una persona infectada con el VIH va perdiendo, de forma progresiva, la función de las células del sistema inmune llamadas linfocitos T CD4, lo que la hace susceptible a desarrollar cierto tipo de tumores y a padecer infecciones oportunistas (infecciones por microorganismos que normalmente no causan enfermedad en personas sanas pero sí lo hacen en aquellas en las que está afectada la función del sistema inmune).
Conviene recordar que la infección por VIH no implica necesariamente que la persona vaya a desarrollar la enfermedad; en esta fase el individuo se considera “seropositivo o portador”, pero es erróneo considerar a la persona infectada con el VIH un enfermo de SIDA. De hecho, se tiene constancia de que algunas personas han sufrido una infección por VIH durante más de diez años sin que, durante este tiempo, hayan desarrollado ninguna de las manifestaciones clínicas que definen el diagnóstico de SIDA.
8.1. Virus de la inmunodeficiencia humana (VIH):
El VIH es un retrovirus perteneciente a la familia retroviridae; es el causante del sida. Los retrovirus se caracterizan porque su material genético está en forma de ARN pero al entrar en la célula hospedante transforman el ARN en ADN mediante la enzima transcriptasa inversa.
8.2. Desarrollo de la enfermedad:
Desde que una persona se infecta con el VIH hasta que desarrolla el sida suelen transcurrir entre seis y diez años. El estudio de la evolución de la enfermedad puede realizarse a través de distintos marcadores de laboratorio o estar basado en la secuencia de aparición de las diferentes manifestaciones clínicas.
Dentro de los marcadores bioquímicos se suele considerar el descenso de la cifra de linfocitos T CD4 que, hasta hace relativamente poco tiempo, ha sido la referencia principal para catalogar el estadio de evolución de la enfermedad. Desde 1996, la determinación de la cantidad de virus circulante en la sangre de la persona infectada, que recibe el nombre de carga viral, se ha convertido en el marcador más importante de la evolución de la enfermedad.
Alrededor de tres semanas después de la infección por el VIH, la mayoría de los pacientes experimentan síntomas pseudogripales como fiebre, cefalea, eritema, linfoadenopatías y sensación de malestar. Estas manifestaciones desaparecen al cabo de una o dos semanas. Durante esta fase, denominada fase de infección aguda, el VIH se multiplica a una gran velocidad, sufriendo diversas mutaciones genéticas. Al principio, se produce un descenso de la cifra de linfocitos T CD4 pero, al poco tiempo, las cifras normales se recuperan en respuesta a una activación del sistema inmunológico. Durante esta etapa los individuos son altamente contagiosos.
El paciente entra entonces en un periodo libre de síntomas, fase asintomática, cuya duración puede ser superior a diez años. Durante esta, el virus continúa replicándose causando una destrucción progresiva del sistema inmunológico. El recuento de linfocitos T CD4 suele ser normal.
En la fase siguiente, denominada fase sintomática precoz, se desarrollan los síntomas clínicos de la enfermedad y es frecuente la presencia de infecciones oportunistas leves.
En la última fase, denominada sida o fase de enfermedad avanzada por VIH, aparecen las infecciones y tumores característicos del Síndrome de Inmunodeficiencia Adquirida.
8.3. Modo de transmisión:
El VIH se transmite por contacto directo y para ello es necesaria la presencia de una cantidad suficiente de virus. Esta proporción solo existe en el semen y otras secreciones sexuales (flujo vaginal), en la sangre contaminada y, en menor cantidad, en la leche materna. El virus penetra en el organismo del individuo sano y entra en contacto con la sangre o las mucosas. Por lo tanto, el contagio del VIH se produce por vía sexual, sanguínea y de la madre al feto o al recién nacido.
8.4. Características epidemiológicas principales:
- Gran distribución mundial.
- Grupos de riesgo: varones homo o bisexuales (60 %), toxicómanos (23 %), contactos heterosexuales (6 %), receptores de sangre y hemoderivados (2 %), hemofílicos (1 %).
8.5. Ciclo de vida del VIH:
El VIH tiene dos dianas principales: el SI y el SNC.
En el SI, las principales células dianas son los linfocitos T CD4+, las células dendríticas y los monocitos-macrófagos. Otras células que expresan bajos niveles de CD4 como los eosinófilos podrían ser dianas potenciales.
Los principales eventos en el ciclo de vida viral son:
- Unión al CD4 y receptor de quimiocina en la superficie de la célula diana. Captación de la glucoproteína 120 por los CD4.
- Fusión de la membrana viral con la membrana de la célula diana, y entrada del genoma viral al citoplasma. Internalización (Gp 41 del genoma viral)
- Liberación del ARN viral y síntesis de ADN proviral mediada por la enzima viral transcriptasa inversa.
- Integración del provirus al genoma celular, puede permanecer bloqueado en el cromosoma: carácter latente.
- Transcripción del genoma viral y ensamblaje de nuevas partículas virales en el citoplasma. Este evento es desencadenado por la activación de la célula diana, típicamente activación mediada por citocinas.
- La frecuencia de producción de células T infectadas en los ganglios linfáticos es mayor que en sangre periférica.
- Expresión del complejo gp120/gp41 viral en la superficie de la célula diana y gemación de las partículas virales.
- Los monocitos y macrófagos constituyen un reservorio del virus y proporcionan un vehículo para su transporte a los diferentes tejidos (SNC).
- Graves afectaciones en la función de las células B, con hiperganmaglobulinemia e inmunocomplejos circulantes. Son incapaces de elaborar una respuesta de Acs frente a un nuevo Ag.
8.6. Inmunopatogenia de la infección con VIH y del sida:
La infección por el VIH cursa por tres fases: la fase aguda, la fase de latencia o crónica, y la fase terminal o de inmunodeficiencia adquirida profunda (sida). La infección aguda producida por el VIH, que en la mayoría de los casos es sintomática inespecífica, es solo parcialmente controlada por la RI del hospedero, y avanza hacia infección crónica progresiva de tejidos linfoides periféricos. Durante la infección aguda mueren muchas células infectadas, y la principal célula diana son los linfocitos T CD4+ en los tejidos linfoides mucosales. La transición de la fase aguda a la fase crónica está acompañada de diseminación viral, viremia, y el desarrollo de la RI del hospedero. En la fase crónica el virus se replica, infecta y destruye nuevas células dianas a un ritmo lento y mantenido. Durante este periodo, el SI combate adecuadamente las infecciones, pero cada infección acelera la producción de nuevas partículas virales y en consecuencia la pérdida de células inmunocompetentes. Por tanto, llega un momento en que el rimo de pérdida de células inmunitarias supera el ritmo en que pueden ser reemplazadas; es entonces cuando se llega a la fase terminal de la enfermedad.
8.7. Mecanismos principales de inmunodeficiencia causados por el VIH:
- Déficit numérico y funcional de linfocitos T CD4+ infectados. Esto ocurre por muchos mecanismos mediados por el virus y otros mecanismos puramente inmunitarios.
- Déficit numérico y funcional de linfocitos T CD4+ no infectados. El principal mecanismo propuesto es: activación crónica y susceptibilidad a la apoptosis de linfocitos no infectados pero estimulados por infecciones que son comunes en pacientes infectados con VIH.
- Trastornos funcionales de los macrófagos, células dendríticas y células dendríticas foliculares.
- Inmunidad humoral defectuosa por trastornos en la colaboración de los linfocitos TH CD4+.
8.7. Diagnóstico:
Aunque el síndrome de inmunodeficiencia adquirida se detectó en 1981, la identificación del virus VIH como agente causal de la enfermedad no se produjo hasta 1983. En 1985 empezó a utilizarse en los bancos de sangre la primera prueba de laboratorio para detectar el VIH, desarrollada por el grupo de investigación de Roberto Gallo. Esta prueba permitía detectar si la sangre contenía Acs frente al VIH. Sin embargo, durante las 4 a 8 semanas siguientes a la exposición al VIH, la prueba es negativa porque el sistema inmunológico aún no ha desarrollado Acs frente al virus.
En general, las distintas pruebas de laboratorio que se utilizan para detectar la infección por el virus de la inmunodeficiencia humana pueden clasificarse en directas e indirectas, según si se intenta demostrar la presencia del virus o de sus constituyentes (proteínas y ácidos nucleicos) o bien la respuesta inmunitaria (humoral o celular) por parte del huésped. El método más utilizado es el estudio de Acs en el suero.
El Centro para el Control y Prevención de Enfermedades de Atlanta (CDC, por sus siglas en inglés) ha establecido la siguiente definición para el diagnóstico del sida: en un individuo VIH positivo el recuento de células T CD4+ debe ser menor a 200 células por milímetro cúbico de sangre, o el individuo debe presentar alguna manifestación clínica definitoria de sida, como infecciones oportunistas por Pneumocystis carinii, candidiasis oral, tuberculosis pulmonar o carcinoma invasivo de cuello uterino en la mujer, entre otros.
8.8. Prevención:
La enfermedad se previene mediante relaciones sexuales responsables y protegidas, y estableciendo barreras a todas las posibles vías de transmisión. No existen vacunas eficaces que prevengan la infección por VIH.
9. ENFERMEDAD AUTOINMUNE
9.1. Consideraciones generales:
Normalmente existen en el organismo Ags que no son detectados por el Sistema Inmune, por encontrarse en tejido a los cuales las células inmunocompetentes no tienen acceso. Son los llamados Ags secuestrados, como los del cristalino y los espermatozoides; cuando las células del sistema inmune logran ponerse en contacto con tales Ags, puede producirse una respuesta de tipo autoinmune contra ellos.
Los Ags del propio organismo pueden ser modificados por agentes químicos que penetren en este o en el curso de algunas infecciones; esta modificación en ocasiones implica la creación de nuevos determinantes antigénicos, contra los cuales se desencadena una respuesta inmune.
Hoy se sabe que las enfermedades autoinmunes no son tan raras y que no todas son dañinas como por ejemplo el reconocimiento de los Ags de superficie codificados por el complejo principal de histocompatibilidad HLA. De ahí que se considere en nuestros días que la enfermedad autoinmune sea el resultado del fracaso o ruptura de los mecanismos normalmente responsables del mantenimiento de la “autotolerancia”.
9.2. Mecanismos de la producción de autoinmunidad:
Actualmente se sabe que las EAI son multifactoriales; a continuación se mencionan los principales factores etiológicos:
1. Alteraciones Linfocíticas:
- Fracaso de la Tolerancia Central.
- Fracaso de la Tolerancia Periférica.
- Ruptura de la anergia de células T.
- Fracaso de la muerte celular inducida por activación.
- Fracaso de la supresión mediada por células T reguladoras.
- Activación policlonal linfocitaria. Ejemplo LPS bacteriano y otros componentes infecciosos.
- Reacciones inmunológicas cruzadas. Respuestas normales reaccionan frente a una proteína propia similar.
2. Factores genéticos:
- Asociación con los genes de histocompatibilidad
- Otros genes importantes en las RI.
3. Relación con infecciones virales y bacterianas:
- Virus de la hepatitis B.
- Fiebre Reumática.
- Infecciones por Estreptococos pyogenes.
4. Alteraciones anatómicas en los tejidos: como en la inflamación secundaria a procesos infecciosos.
- AutoAcs contra el miocardio en personas infartadas después del infarto.
- Proteínas intraoculares y la Uveítis.
- Esperma y su relación con los Orquitis postraumáticas y Orquitis postvasectomía.
5. Las influencias hormonales.
- Ejemplos: la relación del LES (10 veces más frecuentes en mujeres).
- La Tiroiditis Crónica Autoinmune (más frecuente en mujeres).
- La Gastritis Crónica Autoinmune (más frecuente en mujeres).
- La Artritis Reumatoide (más frecuente en mujeres).
9.3. Clasificación de las enfermedades autoinmunes:
Las EAI se clasifican según la localización del órgano afectado en organoespecíficas y sistémicas. Esta clasificación es un tanto cuestionable, pues en las EAI organoespecíficas, que afectan un órgano en particular, se han detectado autoAcs contra Ags ubicuos. Igualmente en las EAI sistémicas se han detectado autoAcs específicos de tejidos.
9.3.1. Organoespecíficas:
- Tiroiditis de Hashimoto.
- Enfermedad de Graves Basedow.
- Enfermedad tiroidea autoinmune
- Enfermedad de Addison idiopática.
- Esterilidad primaria.
- Miastenia Gravis. Acetilcolina.
- Pénfigo. Sustancia intercelular de piel y mucosas.
- Pénfico buloso. Membrana basal de piel y mucosas.
- PTI. Antiplaquetarios.
- Hepatitis B. Antihepatocitos. Antinucleares.
9.3.2. Sistémicas:
- Lupus eritematoso sistémico.
- Artritis reumatoidea.
- Síndrome de Sjogren.
10. SÍNDROME DE SJOGREN
El síndrome de Sjögren o síndrome seco (SS) es una enfermedad autoinmune multisistémica que consiste en una infiltración linfocítica progresiva de las glándulas exocrinas del organismo, que causa una disminución de sus secreciones debido a una atrofia y sustitución del tejido glandular por adipocitos.
Es una entidad clínico patológica caracterizada por sequedad de ojos (queratoconjuntivitis seca) y boca (xerostomía) resultantes de la destrucción inmunológicamente mediada de las glándulas lacrimales y salivales.
10.1. Incidencia:
- De las enfermedades raras, es de las más frecuentes, con una prevalencia del 1,3 %.
- Promedio de comienzo de la enfermedad: 50 años.
- Predomina en las mujeres con una edad entre 40 y 60 años; en jóvenes suele asociarse con otros trastornos autoinmunitarios.
- Se estima que hay cerca de 4 millones de personas con este trastorno, de las cuales el 90 % es de sexo femenino.
- Alrededor del 75 % de los pacientes tienen un factor reumatoideo tanto si la enfermedad coexiste o no con una AR.
10.2. Características generales:
- Se caracteriza fundamentalmente por la sequedad ocular (xeroftalmia) y bucal (xerostomía).
- Es también una enfermedad reumática, que produce dolor e hinchazón en las articulaciones.
- Se considera una enfermedad sistémica.
10.3. Clasificación:
- Síndrome de Sjögren primario: presencia de síntomas y signos de queratoconjuntivitis seca y xerostomía en ausencia de otras enfermedades del tejido conectivo, y en presencia de criterios serológicos o histopatológicos.
- Síndrome de Sjögren secundario: presencia de síntomas y signos de queratoconjuntivitis seca o xerostomía, o ambos, en el escenario de otra enfermedad del tejido conectivo o proceso inflamatorio crónico tales como artritis reumatoide, LES, entre otros.
10.3. Etiopatogenia:
La mayor parte de las investigaciones han estado dirigidas al SS primario; siendo la disregulación de las células T y B, y la contribución de la inflamación innata los problemas principales encontrados. Estos conceptos podrían ser aplicados a la patogénesis del SS secundario, pero en principio muchos defectos inmunológicos en el SS secundario son derivados de los mecanismos patogénicos subyacentes a las enfermedades asociadas.
10.3.1. Los principales factores implicados en el desarrollo de la enfermedad se comentan a continuación:
Factores inmunológicos:
- Pérdida de la tolerancia inmunológica a Ags propios, que implica la tolerancia de células B y de células T. Se ha encontrado un infiltrado intenso de linfocitos T CD4+ y CD8+ (con mayor presencia de las primeras) alrededor de los conductos que se hace más intenso en la medida que avanza la enfermedad.
- Hipergammaglobulinemia (IgG e IgM), factor reumatoide y Acs contra ribonucleoproteinas (anti-Ro/SSA y anti-La/SSB) positivos.
- AutoAcs contra Ags de los conductos salivales.
Factores hormonales:
- La enfermedad aparece de forma desproporcionada en mujeres, sin embargo no se ha demostrado un rol etiológico de los estrógenos y andrógenos.
Factores medioambientales:
- Infecciones virales con citomegalovirus (CMV) y virus de Epstein Barr (VEB) han sido asociadas con el SS primario. Esto se fundamenta en la capacidad de ambos virus de establecer infecciones persistentes y de ejercer efectos supresores de la inmunidad de células T, conjuntamente con el hallazgo de ADN del VEB ha sido detectado en biopsias de glándulas salivales. Sin embargo, la evidencia disponible no es suficiente para demostrar un rol patogénico de estos virus.
Factores genéticos:
- La existencia de muchas familias numerosas con dos o más miembros con SS primario apoya fuertemente la influencia de un componente genético en la patogénesis de la enfermedad. Sin embargo, el SS primario es considerado un trastorno genético complejo, similar a la susceptibilidad genética del LES y la AR. En poblaciones de linaje europeo, las asociaciones HLA confirmadas con SS primario incluyen DRB1*0301 (DR3), DRB1*1501 (DR2), DQA1*0103, DQA1*0501, DQB1*0201, and DQB1*0601.
10.4. Características morfológicas:
- Infiltración linfocitaria pericanacular, que puede ser intensa borrando la arquitectura original (en algunos casos es tan intensa que hace sospechar de un linfoma, sin embargo el aspecto benigno de los linfocitos la población heterogénea celular y la conservación de la arquitectura lobulillar de la glándula permiten diferenciar a estas lesiones del linfoma).
- Las células epiteliales pueden mostrar una hiperplasia que causa oclusión canalicular.
- Atrofia de los acini, fibrosis y hialinización.
- Atrofia y sustitución adiposa del parénquima.
Se desconoce exactamente la causa de la infiltración linfocitaria exocrina; se supone un posible desencadenante viral (herpesvirus, virus de la hepatitis C y retrovirus) y factores neurohormonales en individuos con una marcada predisposición genética.
10.5. Cuadro clínico:
10.5.1 Manifestaciones bucales:
- Resequedad de la boca habitualmente el síndrome más insufrible y a menudo asociado con molestias urentes y dificultad para deglutir y masticar alimentos secos. El paciente bebe cantidades extremas de agua en aras de aliviar los síntomas. Aparece poliuria nocturna.
- La mucosa bucal está seca, eritematosa y la lengua se fisura y ulcera.
- Caries dentales con frecuencia.
- Crecimiento intermitente de la parótida con fluctuaciones rápidas del tamaño de la glándula.
- En este síndrome la glándula parótida es dura en comparación con el crecimiento parotídeo blando característico de la diabetes mellitus o el abuso del alcohol.
10.5.2. Manifestaciones oculares:
- Queratoconjuntivitis seca:
- Disminución del lagrimeo.
- Sensación urente.
- Prurito.
- Acumulación ocular de material mucoide espeso durante la noche.
- Fotofobia.
- Dolor.
- Sensación de arenilla en los ojos.
- Ulceración de la córnea, vascularización, o pacificación, y perforación de la misma.
- Puntitos de rosa de Bengala o Fluoresceína en la conjuntiva, córnea.
- Hilos de ditritos en córnea.
- Acortamiento del tiempo de ruptura de la película de lágrima.
- Disminución del lagrimeo. Prueba de Schirmer: anormal
10.5.3. Diversas manifestaciones:
- Resequedad de la nariz, bucofaringe y laringe.
- Epistasis.
- Disfonía.
- Mucosa vaginal seca.
- Dispareunia.
- Sinovitis.
- 20 % fenómeno de Raynaud.
- 10 % infiltración linfocítica extraglandular. Pulmones y riñones.
- Divertículos.
10.6. Complicaciones:
- Leucocitopenia.
- Explecnomegalia.
- Vasculitis.
- Ülceras en piernas.
- Púrpura con afectación renal.
- Tiroiditis autoinmune 5 %.
- Cirrosis biliar primaria.
- Hepatitis activa crónica.
- Pancreatitis.
- Insuficiencia renal.
- Insuficiencia pulmonar.
- Crioglobulinemia.
- Enf. celíaca.
- Polimiositis.
- Neuropatía periférica.
- Neuropatía corneal.
- Neuropatía periférica craneal (Trigémino).
- Vasculiis cerebral.
- Sarcoma inmunoblástico.
- Macroglobulinemia de Waldestrom.
- Linfoma.
10.7. Diagnóstico:
Las manifestaciones clínicas más características son la xeroftalmía, quemazón ocular, fotofobia, inyección conjuntival, sobreinfecciones de repetición y úlceras corneales dolorosas.
En la boca, sequedad con fisuras en las mucosas, boqueras, dificultad al hablar y deglutir, caries.
Suele afectar a mucosas y piel, pero también a otros órganos o sistemas como pulmones, riñones, tiroides, músculos, aparato circulatorio o el sistema nervioso.
El diagnóstico suele ser tardío dada:
• Su lenta evolución.
• La falta de información y el desconocimiento general de esta afección.
• Los muchos síntomas que se manifiestan y dificultan para la orientación diagnóstica.
Puede haber un período de hasta 10 años entre el comienzo de los síntomas y el diagnóstico de
la enfermedad.
10.8. Laboratorio:
- Anemia.
- Leucopenia.
- Eritro acelerada.
- Disminución del flujo de parótida.- 5ml/10 mts.
- Sioalografía contrastada: desorganización glandular.
- Centelleografía salival:
- Biopsia de glándulas salivales: infiltración de linfocitos de las glándulas exocrinas.
10.8.1. Diagnóstico inmunológico:
- EFP. Hiperganmaglobulinemia policlonal. Paraproteina IgG monoclonal.
- Aglutinación por látex: FR 90 %.
- Acs antinucleares: AAN patrón moteado o homogéneo en el 70 % contra un Ag ácido extriable del núcleo celular.
- Acs antinucleares contra el mitógeno nuclear asociado al virus de Epstein-Barr.
- En el 50 % de los casos AAN contra los conductos salivales.
- Test de roseta: 30 % tiene disminución de los linfocitos T circulantes en sangre.
- Estimulación por mitógenos: 30 % tiene disminución de la respuesta a linfocitos T.
- Predisposición genética a. HLA-DR3 y HLA-B8
10.9. Diagnóstico diferencial:
- Deficiencias nutricionales.
- Trastornos endocrinos.
- Reacciones adversas a medicamentos.
- Cáncer.
10.10. Tratamiento:
- El síndrome de Sjögren no tiene tratamiento curativo.
10.10.1. Medidas generales:
- Para los ojos se aconseja la utilización de gafas de sol, y ungüentos oculares, así como revisiones por oftalmólogo cada semestre.
- Se recomienda no fumar ni beber alcohol, evitar los ambientes secos como por aire acondicionado o calefacción, así como lugares con polvo y humo de tabaco.
- Se debe aconsejar protectores labiales, higiene bucal con cepillado de dientes frecuente, utilización de hilo dental a diario.
- Para la piel se recomienda el empleo de aceites o hidratantes corporales. En las mujeres se aconseja el empleo de lubricantes vaginales, así como revisiones ginecológicas frecuentes.
Hay dos tipos de tratamiento: tratamiento local con medidas paliativas y medicación enfocada específicamente para la sintomatología seca y el tratamiento farmacológico dirigido a la afectación sistémica de la enfermedad.
10.10.2. Tratamiento bucal:
- Mantener una higiene extrema con pastas dentríficas con fluoruro, lavados bucales y examen dental regular.
- Tragos frecuentes de agua.
- Gomas de mascar sin azúcar para estimular la secreción salival.
- Aeresol de saliva artificial.
- Humedecedor de la recámara.
- Soluciones mucolíticas.
10.10.3. Tratamiento ocular:
- Oclusión en punto lagrimal.
- Lágrimas artificiales. Metilcelulosa.
- Uso de glucocorticoides e inmunosupresores (en enfermos graves ó con Linfomas)
10.10.4. Tratamiento sistémico:
- Antimflamatorios no esteroideos (AINEs) para los dolores.
- Corticoisteroides.
- Metrotexate.
- Hidroxicloroquina.
- Ciclofosfamina.
ANEXOS
ANEXO 1. CEPILLADO DE LOS DIENTES
Una buena higiene comienza con un correcto cepillado que conviene realizar justo después de cada comida, ingesta de bebidas, especialmente las azucaradas y carbonaradas, de golosinas o aperitivos o de cualquier alimento. El cepillado más importante y el que no debe faltar, es el de después de la cena o de la última ingesta antes de dormir. Hay alimentos duros como la zanahoria cruda que al ser mordidos arrastran la placa bacteriana. Otros alimentos como el queso parecen tener propiedades remineralizantes del esmalte.
Sin embargo un cepillado puede incidir en un temprano desgaste del esmalte, en especial si se han ingerido cítrico después de las comidas, por lo que lo ideal está entre 2 y 3 cepillados diarios.
El uso de chicles puede ser aconsejable. La acción de masticar estimula la secreción de saliva que evita que el pH de la boca se vuelva excesivamente ácido. El xilitol inhibe el crecimiento bacteriano del Estreptococcus mutans que causa la carie Estos chicles no sustituyen las ventajas del cepillado.
La higiene bucodental es igualmente necesaria si se ha producido regurgitación o vómito.
Las encías sanas no sangran con el cepillado. Si se observa un sangrado evidente con un cepillado normal, lo más probable es que se esté ante un caso de gingivitis.
La solución es sencilla: acudir a un odontólogo o estomatólogo para que se realice una buena limpieza del espacio gingivo dentario con ultrasonidos. Es recomendable que esta limpieza profesional se efectúe al menos dos veces al año. La higiene ha sido esencial para el ser humano para la salud y el buenestar.
La placa dental bacteriana constituye la principal causa de las caries y de las enfermedades de las encías. Se forma a partir de restos de alimentos y bacterias y la mejor forma de eliminarla es mediante el cepillado de dientes y encías.
Los principales responsables de este cuidado son: las madres y padres, miembros de la familia y educadores en las primeras etapas, los que deben inducir a niñas y niños en la responsabilidad de su autocuidado.
El cepillado debe realizarse siempre de la encía al diente y en las caras masticatorias en forma circular o rotatoria. Debe higienizarse también la lengua. Dentro de la odontología preventiva, el cepillado dental es el método más ampliamente difundido y cuenta con un alto grado de aceptación social.
El cepillo debe ser de uso personal, guardarse bien limpio en un lugar ventilado y debe sustituirse cada tres meses.
1.1. Características del cepillado:
-Forma:
De acuerdo con las características del paciente. En Cuba la más utilizada es la técnica de Stillman modificada. Otras de las técnicas que se han desarrollado fundadas básicamente en el movimiento impreso del cepillo son: horizontal y vertical, rotatoria, vibratoria, circular, fisiológica y de barrido.
-Duración:
Para cubrir los 4 cuadrantes se necesitan aproximadamente 3 minutos.
La efectividad del cepillado dental depende de un conjunto de factores:
- Diseño de los cepillos.
- Tipo de dentífrico utilizado.
- Frecuencia de cepillado.
1.2. Diseño del cepillo:
La elección del cepillo dental debe determinarse en función de la salud bucal del paciente, de su destreza manual y de sus preferencias personales.
Los cepillos pueden ser manuales o eléctricos.
Para elegir adecuadamente un cepillo dental, es importante tener en cuenta:
- El tamaño de la cabeza del cepillo debe ser lo suficiente pequeño para permitir una buena maniobra en la cavidad bucal.
- La parte activa del cepillo debe tener forma recta y múltiples penachos.
- El largo de la superficie activa debe cubrir dos dientes vecinos.
- El mango tiene que ser recto y largo para permitir la adhesión palmar.
- Las cerdas deben ser de nylon blandas y de puntas redondeadas. Esto garantiza la capacidad de absorción de agua, la resistencia a la abrasión y la recuperación de la flexibilidad.
- El número de hileras de penachos está sujeto al ancho de la cabeza. Debe haber suficiente espacio entre tres o cuatro filas (que es lo recomendado) para garantizar la buena flexibilidad de las fibras y el fácil secado.
1.3. Tipo de dentrífico:
La pasta o gel dental utilizado debe ser a base de flúor y la concentración del mismo depende del tipo de patología que tenga cada paciente. Lo indicado es seguir el consejo del odontólogo.
La crema dental debe dosificarse en cantidades moderadas. Maño de una alverja.
-Frecuencia óptima del cepillado:
- Después del desayuno.
- Después de las comidas.
- Antes de acostarse. El más importante.
Depende de la cantidad y la calidad de hidratos de carbono consumidos. Si una persona consume carbohidratos un máximo de cuatro veces al día, un cepillado diario correctamente efectuado, es decir que disminuya la cantidad de placa dental aceptable, resulta suficiente. Deberá agregar tantos cepillados como consumo de carbohidratos haya sumado a la ingesta.
El tiempo mínimo estimado para cubrir todas las zonas que necesitan ser limpiadas con la cantidad de movimientos apropiados es de cinco minutos, incluyendo el pasaje de hilo dental.
Los hidratos de carbono de la dieta son metabolizados por los microorganismos de la placa bacteriana y uno de los productos finales son los ácidos. La calidad de la ingesta de carbohidratos afecta al pH y al tipo de placa. La metabolización de la sacarosa produce ácido láctico, que tiene la capacidad de descender el pH hasta el nivel crítico y causar la disolución del esmalte. La metabolización de almidones produce ácidos más débiles. El descenso del pH de la placa bacteriana se inicia a los pocos minutos de ingerir el hidrato de carbono, especialmente la sacarosa, y retoma su nivel inicial dentro de los 40 minutos siguientes, si la saliva mantiene su condición buffer. La frecuencia del consumo de hidratos de carbonos acentúa progresivamente el pH ácido de la placa.
1.4. Técnicas de Cepillado:
-Técnica de Bass:
En esta técnica el cepillo se coloca en ángulo de 45 grados contra la unión del diente con la encía, luego se realiza un movimiento horizontal para remover la placa bacteriana. Para las caras internas de los incisivos superiores e inferiores, se cepilla verticalmente con el cepillo. La superficie de masticación de los molares y premolares se cepillan por medio de movimientos de frotamiento hacia adelante y atrás. Esta técnica es recomendable en especial para pacientes adultos que sufran de enfermedad periodontal.
-Método combinado:
Combina ambas técnicas anteriormente descritas. Se realiza la técnica de Bass y luego barrer las encías y los dientes empleando la técnica rotacional.
-Técnica de Stilman:
Las cuerdas del cepillo se inclinan en un ángulo de 45 grados dirigidas hacia el ápice del diente; al hacerlo debe cuidarse que una parte de ellas descanse en la encía y otra en el diente. De ese modo se hace una presión ligera y se realizan movimientos vibratorios.
-Técnica de Charters:
El cepillado con esta técnica es de utilidad para limpiar las áreas interproximales. Las cerdas del cepillo se colocan en el borde gingival formando ángulo de 45 grados y apuntando hacia la superficie oclusal. De este modo se realizan movimientos vibratorios en los espacios interproximales. Al cepillar las superficies oclusales se presionan las cerdas en surcos y fisuras y se activa el cepillo con movimientos rotatorios sin cambiar la posición de la punta de las cerdas. El cepillo se colocó de manera vertical durante el aseo de la cara lingual de los dientes anteriores. Esta técnica se utiliza también alrededor de aparatos ortodónticos y cuando está desapareciendo el tejido interproximal, pero no se recomienda cuando están presentes las papilas.
-Técnica de Francisa:
El cepillado con esta técnica consiste en limpiar las áreas visibles más que las ocultadas ya que no se notan, frotarse cuidadosamente las papilas. Esta es la forma más utilizada en el limpiado de dientes, aunque los doctores prefieren utilizar el método combinado.
1.5. Recomendaciones:
No olvidar cepillar la lengua y el paladar. Un buen cepillado debiera durar al menos tres minutos, dos veces al día es lo perfecto, es malo por exceso y por defecto.
En la actualidad algunas compañías están lanzando al mercado cepillos dentales con limpiadores de lengua con el fin de facilitar esta tarea.
ANEXO 2. LAVADO DE MANOS. Clave para la prevención de enfermedades.
El Día Mundial del Lavado de Manos se celebra el 5 de mayo.
Ese día se desarrollan charlas, educación en el trabajo se reparten boletines para el Lavado de Manos, orientado por el MINDAP/Epidemiología y la OPS/OMS
Normalmente transportamos en nuestras manos millones de microbios, en su gran mayoría inofensivos. Otros, sin embargo pueden causar enfermedades como resfrío común, gripe, diarrea, hepatitis y algunos tipos de meningitis entre otras.
Si nos olvidamos de lavarnos las manos o no lo hacemos adecuadamente podemos diseminar gérmenes a otras personas o auto contagiarnos cuando tocamos los ojos, la boca, la nariz o una lastimadura.
Cada uno de nuestros hogares concentra gran cantidad de gérmenes Un niño que trae gérmenes al hogar desde la guardería o la escuela, puede infectar a dos terceras partes de la familia. Como ejemplo el virus de la gripe puede sobrevivir más de 48 horas en superficies como teclas de luz, control remoto, tubos de teléfonos y picaportes, entre otros. El lavado de manos reduce considerablemente su trasmisión. Esta práctica fue descubierta por el médico Húngaro Ignaz Semmelweis en 1847 quien trabajaba en el hospital general de Viena. El observó que las parturientas atendidas por parteras, morían menos de fiebre puerperal que aquellas asistidas por médicos y practicantes. Al analizar las diferencias entre las prácticas de uno y de otro grupo, encontró que las parteras se lavaban las manos antes de atender a las mujeres. Semmelweis dispuso el lavado de manos obligatorio y demostró el gran impacto de esta simple medida al disminuir ostensiblemente la mortalidad materna. A pesar de este asombroso resultado, fue expulsado del hospital por sus superiores quienes creían que las enfermedades se trasmitían por los miasmas del aire. Luego de más de un siglo y medio, el lavado de manos es considerado la piedra fundamental en la prevención de las infecciones hospitalarias como también en el ambiente del hogar y el trabajo.
La reciente epidemia de Gripe A H1N1 nos demostró nuevamente la importancia del lavado de manos. La difusión de esta práctica junto con otras medidas preventivas ayudó a mitigar la epidemia y disminuir el ausentismo escolar y laboral.
2.1. Higiene de las manos:
La higiene de manos es el término que se aplica a cualquier lavado de manos, lavado antiséptico de manos, antisepsia de manos por frotación o antisepsia quirúrgica de manos, que se realiza en los centros sanitarios para prevenir las infecciones relacionadas con la atención sanitaria (IRAS). Las IRAS se definen como la infección que afecta a un paciente durante el proceso de atención en el hospital u otra instalación de atención sanitaria que no estaba presente no se estaba incubando en el momento del ingreso. En la aparición de la IRAS influyen múltiples factores.
No obstante la Higiene de las manos siempre antes y después de estar en contacto con un paciente, es probablemente el -único factor relacionado con la transmisión de los microorganismos común a la mayor parte de las infecciones.
Por ello, se considera desde hace mucho tiempo, la medida de prevención más eficiente para evitar enfermedades infecciosas.
En el año 2009 la Organización Mundial de la Salud (OMS) publicó la Guía sobre la Higiene de manos en los centros sanitarios, que explica el modelo de os 5 momentos.
Los momentos en que los profesionales de los centros sanitarios de todo el mundo deben realizar la higiene de manos.
2.1. Indicaciones:
En los 5 momentos que indica la OMS:
-
Antes del contacto con el paciente.
-
Antes de realizar una tarea limpia antiséptica.
-
Después del riesgo de exposición a líquidos corporales.
-
Después del contacto con el paciente.
-
Después del contacto con el entorno del paciente.
2.3. Tipos de lavados de manos:
-
Lavado de manos Rutinario.
-
Lavado de manos Antiséptico.
-
Lavado de manos Quirúrgico.
2.4. Condiciones generales:
- Mantener las uñas cortas y limpias, sin esmaltes y sin pórtico. Las uñas largas aumentan el riesgo de roturas de guantes.
- No usar anillos, relojes ni pulseras. Estos elementos actúan como reservorio y dificultan la limpieza de manos y antebrazos.
- El uso de cremas hidratantes después de la actividad laboral se considera recomendable, porque aumenta la resistencia de la piel y al mantenerse íntegra disminuye la contaminación por gérmenes.
- Usar preferiblemente los jabones con dosificador.
- No reutilizar los envases de jabón ya que se contaminan fácilmente.
- Usar toalla de papel ya que la de tela se contamina fácilmente.
El agua corriente elimina de forma mecánica los elementos microscópicos; en cuanto al jabón, emulsiona la materia extraña y reduce la tensión superficial, lo que facilita la eliminación de aceites, grasas y suciedades. Se empleará siempre que se perciban las manos sucias, al realizar actividades personales, antes y después del contacto con el paciente en procederes invasivos y sin riesgos. El lavado de manos nos permite evitar la diseminación de gérmenes a otras personas o auto-contagiarnos cuando nos tocamos los ojos, la boca, la nariz o una lastimadura.
Es muy importante lavarse las manos con regularidad, sobre todo antes de manipular o comer alimentos o tocar a otras personas. (más si estas se encuentran enfermas). Las manos sucias, aun cuando a simple vista no parezcan estarlo, son u foco de propagación de infecciones que no debe obviarse: los virus y bacterias están a sus anchas en las manos de aquello que se resisten a pasarlas por agua y jabón.
Es fundamental lavarse las manos en algunas situaciones puntuales como por ejemplo antes de preparar la comida o ponernos los lentes de contacto, curar una herida o atender a alguien enfermo. Y no olvidar de lavarse después de realizar actividades como; ir al baño, tose, estornudar, sonarse la nariz, manipular alimentos crudos, tocar basura, cambiar pañales, atender a un enfermo, tocar animales, asistir a un lugar público.
El simple enjuague de las manos sin jabón no es suficiente para eliminar los gérmenes, por lo que saber su ejecución adecuadamente, es tan importante como hacerlo cuando corresponde. Saber lavarse las manos adecuadamente, es tan importante como hacerlo cuando corresponde. Para ello debemos utilizar jabón y agua tibia (el jabón líquido es menos contaminable).
Lavar bien toda la superficie de las manos incluyendo muñecas, palmas, dorso y dedos. Además cepillar bien debajo de las uñas. Frotar las manos enjabonadas por 15 segundos, enjuagar bien, y secar utilizando una toalla de papel descartable, una toalla de tela (en el hogar) o un secador de aire caliente para evitar dañar a la piel durante el procedimiento.
2.5. Clasificación del lavado de las manos en la APS:
2.5.1. Lavado rutinario de las manos
Es la limpieza mecánica de las manos con agua y jabón convencional, que elimina todo tipo de suciedad visible. El enjuague debe ser abundante y terminará en el secado. Se emplearán siempre que se perciban las manos sucias, al realizar actividades personales que lo requieran, antes y después del contacto con el paciente en procederes no invasivos y sin riesgos.
Su objetivo es eliminar la flora transitoria de las manos y la suciedad y materia orgánica si la hubiera.
2.5.2. Lavado higiénico o médico de las manos:
Es la limpieza mecánica de las manos con agua y jabón convencional, las que se frotan en forma enérgica y enjuague abundante durante un minuto y después del secado se utiliza solución antiséptica; este tipo de lavado de manos se utilizará antes de las maniobras semicríticas.
2.5.3. Lavado quirúrgico de las manos:
Es la limpieza mecánica de las manos con agua y cepillo, utilícese además solución antiséptica después del secado. Se procederá antes de cualquier maniobra crítica.
2.6. Productos especiales para combatir los gérmenes (aplicar de 3 a 5 ml)
El alcohol en gel es un excelente desinfectante y es muy seguro. Es muy usado por profesionales de la salud y también en situaciones donde no hay agua disponible. Para usar el alcohol en gel las manos no deben estar visiblemente sucias.
La yodopovidona no es tóxica ni irritante. Su efecto germicida actúa en presencia de sangre, pus, suero y otros microorganismos de alta resistencia. Se utiliza para lavar heridas sucias y para el baño de pacientes.
La clorhexidina tiene una actividad germicida parecida a la de la yodopovidona. Se caracteriza por un importante efecto residual por el cual sigue actuando aún luego del lavado.
2.7. Consejos útiles
Las manos deben lavarse regularmente:
-
Antes y después de comer.
-
Antes y después de preparar alimentos.
-
Después de cambiar pañales.
-
Al llegar a casa.
-
Antes y después de ir al baño.
-
Después de estornudar o toser.
- Si se ha tocado alguna superficie de dominio público, como la barra de un bar, un baño público, un mause, una barra de escaleras públicas, etc.
Las manos hay que lavarlas bien, bajo un grifo y con jabón. Tampoco ha de olvidarse la higiene de las uñas y de la parte interna de los dedos. Luego es conveniente secarse preferiblemente con servilletas de papel (si puede utilizar otra servilleta para cerrar el grifo y para salir del baño aún mejor, sobre todo si está en un baño público. Procure no tocar su cara so no es estrictamente necesario, ya que tanto en la boca como en la nariz se ubican fácilmente muchos gérmenes que luego con la ayuda de las manos, se propagan con rapidez.
2.8. Técnica para realizar el lavado de manos
-
Humedecer las manos con agua preferiblemente templada.
-
Aplicar una dosis de jabón preferiblemente con dosificador.
-
Frotar palma con palma, palma sobre dorso espacios interdigitales y muñecas durante al menos 10 segundos.
-
Aclarar con abundante agua.
-
Secarse con toalla desechable y cerrar el grifo con la misma toalla evitando tocarlo.
-
En el caso del lavado de manos quirúrgico:
El objetivo es más amplio, eliminar la flora bacteriana transitoria, y al máximo la flora bacteriana residente en las manos, previo a un procedimiento invasivo que por su especialidad o su duración requiere un alto grado de asepsia y efecto residual antimicrobiano prolongado. El lavado se realiza con grifos de pedal o codo, agua, jabón antiséptico (Clorhexidina al 4 % o Yodopovidona al 7.5 %), cepillo de uñas desechable (preferentemente impregnado con solución antiséptica), toalla o compresa estéril.
2.8.1. Técnica con solución alcohólica
-
Abrir el grifo y humedecer las manos y antebrazos con agua.
-
Aplicar jabón dermoprotector durante al menos 1 minuto.
-
Lavado mecánico de manos y antebrazos limpiando con el cepillo solo debajo de las uñas. No frotar con el cepillo el resto de la piel para evitar lesiones.
-
Aclarar con abundante agua corriente.
-
Aplicar de nuevo jabón antiséptico en manos y antebrazos friccionando al menos durante 2 minutos.
-
Aclarar con abundante agua.
-
Secar por aplicación, sin frotar, con una compresa o toalla desechable estéril, comenzando por los dedos y bajando hasta los codos.
-
Verter el desinfectante en las manos ayudándose del dispensador, apretando con el codo.
-
Aplicar la solución alcohólica en cantidad suficiente para mantener húmedas de 3 a 5 minutos, friccionando las manos, antebrazos y codos, poniendo especial atención en espacios interdigitales, pulgares y uñas.
-
Aplicar una dosis final para antebrazos, terminando en manos.
-
No secarse las manos, dejar que se evapore el producto y no colocarse los guantes hasta su total secado.
-
Durante todo el proceso mantener las manos por encima de los codos.