INTRODUCCIÓN
La enfermedad de Wilson (EW, MIM 27790) es un trastorno hereditario que presenta un patrón de herencia autosómico recesivo. Se caracteriza por la acumulación de cobre fundamentalmente en el hígado, cerebro y córnea. El diagnóstico clínico de esta enfermedad resulta complejo.1 Sus manifestaciones hepáticas varían desde la alteración de los niveles séricos de transaminasas hasta una cirrosis descompensada. Las afectaciones a nivel cerebral pueden manifestarse con temblores y llegar a desencadenar enfermedad de Parkinson en algunos casos. Es una enfermedad genética tratable; sin embargo, algunas de las alteraciones que provoca son irreversibles y pueden llevar a la muerte de no atenderse de forma adecuada. La causa molecular que la induce son las mutaciones en el gen atp7b (MIM 606882), que presenta 21 exones y del cual se han reportado más de 500 mutaciones hasta la actualidad.1-2
Además, se han identificado más de 139 polimorfismos que están distribuidos en todo el gen atp7b y en los intrones; los exones más polimórficos reportados son 2, 8 y 16, aunque en el exón 13 se han identificado varios polimorfismos.3
El polimorfismo T991T se encuentra localizado en el exón 13 del gen atp7b. Ha sido identificado en diversas poblaciones, en países como la India, Canadá, Reino Unido e Irán.
Se describen pocos estudios moleculares en el gen atp7b en América. En un estudio en el que se analizan pacientes con diagnóstico clínico de la Enfermedad de Wilson en Estados Unidos y Puerto Rico, se identifica el polimorfismoT991T, aunque no se reporta la frecuencia alélica.4
Para la determinación del espectro mutacional y la identificación de polimorfismos en el gen atp7b, se requiere de una adecuada tecnología de cribaje. Una de las técnicas más utilizadas para este propósito es el polimorfismo conformacional de simple cadena, SSCP (del inglés single-strand conformation polymorphism).5
Considerando que en Cuba no existe el diagnóstico molecular de la EW, es objetivo de este estudio identificar los cambios conformacionales en el exón 13 y detectar el polimorfismo T991T en el gen atp7b de pacientes cubanos con diagnóstico clínico de esta enfermedad. La identificación del SNP (polimorfismo de un solo nucléotido) va a constituir una herramienta molecular para el asesoramiento genético adecuado para el individuo afectado y la familia.
MÉTODOS
Se realizó un estudio descriptivo, en el Centro Nacional de Genética Médica, durante el período 2011-2013, que incluyó seis familias cubanas que sumaron 24 pacientes y 11 pacientes independientes, para un total de 35 individuos (14 mujeres y 21 hombres) con diagnóstico clínico de EW, los cuales asistían a la consulta del Instituto Nacional de Gastroenterología. Estos pacientes dieron su consentimiento para participar en la investigación, de acuerdo con los principios éticos de la declaración de Helsinki. Este estudio fue aprobado por el consejo científico y el comité de ética del Centro Nacional de Genética Médica.
Las variables analizadas fueron: edad de inicio de las manifestaciones clínicas de EW, provincia de procedencia, frecuencia alélica del polimorfismo T991T (cambio conformacional a para la variante normal y cambio conformacional b para la presencia del polimorfismo T991T en estado heterocigótico), manifestaciones clínicas (hepáticas, neurológicas, asintomáticos), concentración de ceruloplasmina en sangre, resultado de biopsia de tejido hepático, presencia de los polimorfismos T991T y K832R, presencia de la mutación L708P. Todas estas variables fueron registradas en una base de datos en el Centro Nacional de Genética Médica.
La evaluación de las manifestaciones clínicas fue realizada por un equipo multidisciplinario (gastroenterólogos, genetistas, neurólogos, bioquímicos), siguiendo los criterios de diagnóstico de la enfermedad.
La concentración de ceruloplasmina en sangre se determinó en el Instituto Nacional de Gastroenterología por el método colorimétrico descrito por Ravin.6 Las determinaciones de cobre en tejido hepático se realizaron por espectrofotometría de absorción atómica, en el espectrofotómetro Perkin Elmer, modelo 2380, según Osheim y Ross.7
Los estudios moleculares se realizaron en Centro Nacional de Genética Médica, en el laboratorio de Biología Molecular. Para la detección de cambios conformacionales y la identificación del polimorfismo T991T, se seleccionó el exón 13 del gen atp7b. A todos los pacientes se les tomó una muestra de ADN, mediante el método de precipitación salina8 a partir de 10 ml de sangre periférica con ácido etildiaminotetraacético (EDTA, del inglés Ethylene DiamineTetra Acetic Acid) (56 mg/ml).
Las condiciones para la amplificación del exón 13 mediante la técnica de Reacción en Cadena de la Polimerasa (PCR, del inglés Reverse Transcription Polymerase Chain Reaction), fueron: 100ng de ADN, pmoles/ml de cada oligonucléotido del exón 13:
(F) 5'-AGT CGC CAT GTA AGT GAT AA-3' y (R) 5'-CTG AGG GAA CAT GAA ACA A-3', 1mM de dNTPs (Boehringer), 10X tampón PCR, 15mM de MgCl2, 1u de Taq polimerasa (Amplicen), en un volumen de 25 µl.9
Posteriormente se realizó la electroforesis SSCP. Se mezcló 3,5µl con una solución de parada de bromofenol azul (0,05 % BFA, 10mM NaOH, 95 % formamida, 20mM EDTA) y 1 µl del producto amplificado, en un volumen final de 7µl. Se aplicó en un gel de acrilamida comercial (GeneGel Excel 12,5/24 Kit). La visualización del ADN se realizó por el método de tinción con plata, siguiendo las instrucciones del juego comercial: kit PlusOne DNA Silver Staining (Amersham Biosciences, 2007).
Se procedió a la secuenciación del patrón alterado por SSCP. El secuenciador utilizado fue ALF-Express. Un paso crítico y decisivo fue la purificación del producto de PCR, el cual se realizó con el juego comercial de la Quigen (QIAquick, PCR Purification Kit).
Esta investigación es uno de los resultados del proyecto ramal Estudio molecular de familias cubanas con la EW.
RESULTADOS
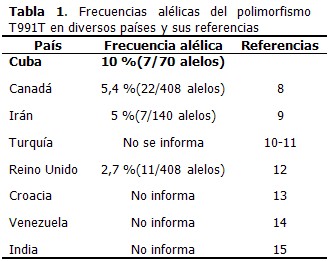
La frecuencia alélica en los 35 pacientes estudiados fue de 10 %. (Tabla 1).
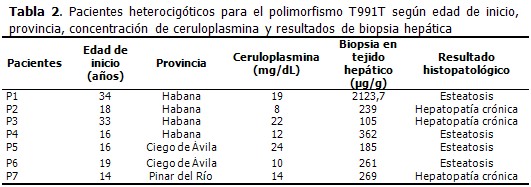
El polimorfismo T991T en estado heterocigótico fue identificado en el 20 % de los pacientes. La media de la edad de inicio de EW de los pacientes que resultaron heterocigóticos para el polimorfismo T991T fue 21,4 años. En el 71,4 % de los pacientes los niveles de concentración de ceruloplasmina fueron menores que 20mg/mL (criterio diagnóstico de EW). El 57,1 % de los pacientes presentó una concentración de cobre en tejido hepático mayor que 250µg/g de tejido seco (criterio diagnóstico de EW). En cuanto al resultado histopatológico, la hepatopatía crónica mostró un ligero predominio respecto a la esteatosis. (Tabla 2).
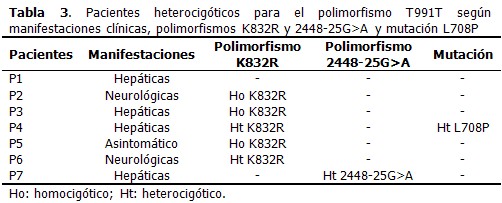
Entre las principales manifestaciones clínicas en los pacientes que presentaron el polimorfismo T991T, fueron más frecuentes las hepáticas (57,1 %), seguidas de las neurológicas, identificadas en el 28,6 %. Solo un paciente se mostró asintomático. También se encontraron otros polimorfismos y mutaciones del gen atp7b en estos pacientes. (Tabla 3).
DISCUSIÓN
En Cuba se comienza a realizar la detección de polimorfismos en el gen atp7b en el año 2008. Un paso previo a la búsqueda de mutaciones y polimorfismos en este gen, es la detección de cambios conformacionales. Este polimorfismo no afecta la función de la proteína y se ha identificado en diversas poblaciones con una frecuencia mayor que 1 %. La frecuencia alélica del polimorfismo T991T obtenida en este estudio, es más alta que la reportada por otros países (Tabla 1).8-12 Una posible explicación de este resultado puede ser el origen genético, pero habría que estudiar una población mayor para llegar a juicios más concluyentes.
El polimorfismo T991T es consecuencia de un cambio de citosina por guanina, lo cual no provoca el cambio del aminoácido Treonina en la posición 991 de la proteína atp7b en el sexto segmento de transmenbrana.
Se obtuvo que en el 71,4 % de los pacientes que presentaron el polimorfismo T991T, se identificó además el polimorfismo K832R, ubicado en el exón 10 del gen atp7b; asimismo, se identificó en un solo paciente el polimorfismo 2448-25G>A. Se esperaba encontrar ambos polimorfismos, pues en estudios anteriores se obtuvo para ellos una frecuencia alélica de 35 % y 8,5 % respectivamente.18,19
También se identificó, en un paciente heterocigótico compuesto para los polimorfismos T991T y K832R, la mutación L708P, localizada en el exón 8 y frecuente en Islas Canarias. Esta mutación ha sido identificada en otros pacientes cubanos con la enfermedad de Wilson.20
Los polimorfismos K832R, T991T y 2448-25G>A pueden ser utilizados en las familias cubanas con algún individuo enfermo, para la realización de los haplotipos y realizar el diagnóstico por el método indirecto. Además, se pueden establecer relaciones entre los haplotipos y las mutaciones, similar a lo realizado por Paradisi y colaboradores en Venezuela.16
Debido al pequeño tamaño de la muestra no es factible establecer una relación entre la presencia del polimorfismo T991T con la edad de inicio, las manifestaciones clínicas y los resultados de la biopsia hepática. Sin embargo, la identificación del polimorfismo T991T, disponible en la Red Nacional de Genética Médica y el Instituto Nacional de Gastroenterología, permitirá en un futuro inmediato el diagnóstico molecular por métodos indirectos y su correlación con las manifestaciones clínicas presentes en los pacientes con EW, por lo que será una herramienta molecular para el asesoramiento genético.