INTRODUCCIÓN
Entre las causas principales de mortalidad y morbilidad en los pacientes con insuficiencia cardiaca congestiva (ICC) sintomática, se encuentran las relacionadas con las alteraciones de la función renal, las cuales favorecen la retención de sodio y agua, y en consecuencia, la expansión del volumen intravascular y aumento de la precarga cardiaca. Esto supone el aumento del volumen del líquido extravascular e intersticial, que se manifiesta clínicamente como edema pulmonar y periférico.
En ausencia de otras causas de insuficiencia renal, el síndrome hepatorrenal se presenta en pacientes con enfermedad hepática avanzada, como un cuadro de insuficiencia renal aguda (IRA) oligúrica. Suele aparecer en pacientes hospitalizados, sin causa aparente y con función renal disminuida al ingresar. La ascitis es constante, la ictericia es variable, la tensión arterial suele ser menor que la habitual y la concentración urinaria de sodio es muy baja. La hiponatremia en grado variable también es constante y el patrón es indistinguible de la insuficiencia renal prerenal reversible. El pronóstico es pésimo y la mayoría de los pacientes fallecen en tres semanas, aún recibiendo la atención adecuada.
DESARROLLO
Conocer la patogenia de la retención de agua y sodio en el riñón, permite usar de modo racional los tratamientos médicos convencionales y experimentales en la ICC. (1-4)
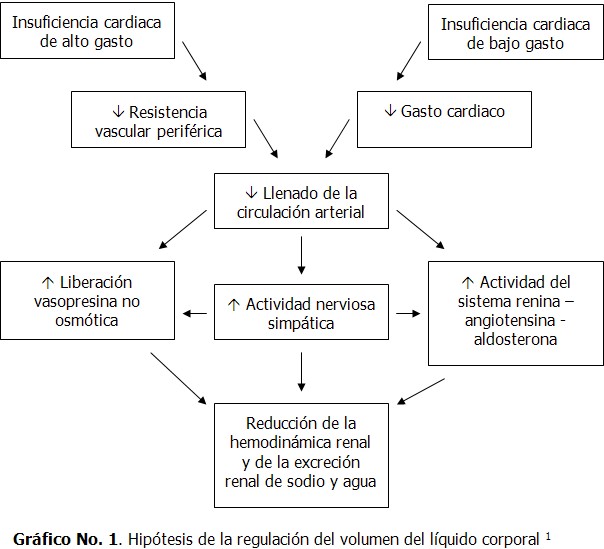
La reducción del gasto cardiaco puede iniciar la retención de sodio y agua en la insuficiencia cardiaca (IC) de bajo gasto. (5,6)
En las formas de ICC de alto gasto y otros estados edematosos (cirrosis, embarazo, grandes fístulas arteriovenosas), el mecanismo propuesto es la vasodilatación arterial. (Gráfico 1)
Cambios de la hemodinámica renal en la ICC
La tasa de filtración glomerular (TFG) suele ser normal en la insuficiencia cardiaca leve y se va reduciendo solo cuando el rendimiento cardiaco se altera gravemente. La resistencia vascular renal aumenta, con el consiguiente descenso del flujo sanguíneo renal (FSR). (5,7)
En general, el FSR desciende en proporción directa con la reducción del rendimiento cardiaco, por lo que la fracción de filtración (cociente entre la TFG y el FSR) suele estar aumentada en los pacientes con IC (7,8). El incremento de la fracción de filtración es consecuencia del predominio de la constricción de la arteriola eferente dentro del riñón, mediada por la mayor actividad adrenérgica renal y angiotensina II. (6-8)
Estos cambios en la hemodinámica renal modifican las fuerzas hidrostáticas y oncóticas de los capilares peritubulares. (7,8)
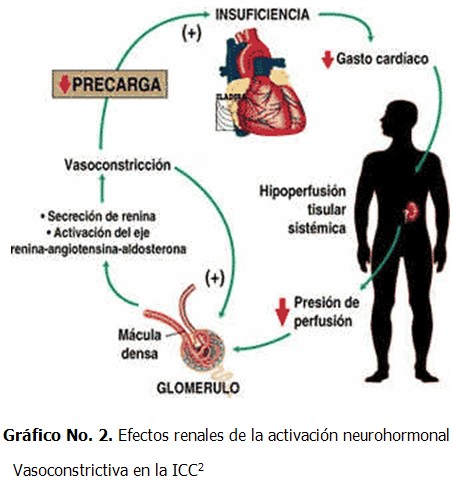
Efectos renales de la activación neurohormonal vasoconstrictiva en la ICC
El aumento de la actividad adrenérgica renal y de angiotensina II (Gráfico 2) determina: (7)
1. Constricción más intensa de las arteriolas eferentes que las aferentes.
2. Aumento de la reabsorción de sodio en el túbulo proximal.
3. Estímulo a la liberación de renina.
4. Estímulo a la síntesis y liberación de aldosterona adrenal, que aumenta la reabsorción de sodio y excreción de iones potasio e hidrógeno, en el túbulo colector.
5. La arginina vasopresina aumenta la reabsorción de agua en el túbulo colector cortical y medular, y aumenta la reabsorción de cloruro sódico en la rama ascendente medular del asa de Henle.
Efectos renales de los vasodilatadores hormonales en la ICC
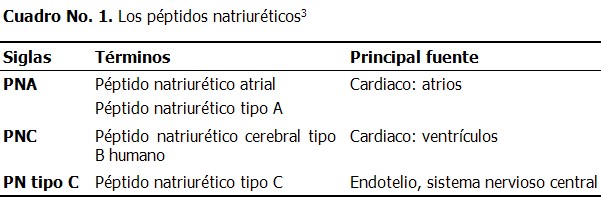
Se ha observado que en la disfunción temprana del ventrículo izquierdo, la activación del sistema de renina-angiotensina-aldosterona y el sistema nervioso simpático renal, es inhibida por la acción de los péptidos natriuréticos. Sin embargo, la respuesta renal a los péptidos disminuye a medida que la insuficiencia cardiaca empeora, incluso si las concentraciones plasmáticas de los péptidos se ven aumentadas. La familia de los péptidos natriuréticos está compuesta por: péptido natriurético atrial (PNA), péptido natriurético cerebral (PNC) y péptido natriurético tipo C (Cuadro 1). La prehormona precursora para cada uno de ellos, es codificada por un gen separado. La distribución específica en los tejidos y la regulación de cada péptido es única. (6,9,10)
Algunas de las funciones de los péptidos natriuréticos, son las siguientes: (6,7)
1. Incrementan la TFG.
2. Inducen una disminución de la reabsorción de sodio en el túbulo colector.
3. Suprimen la actividad de la renina, así como la síntesis y liberación de la aldosterona.
4. Las prostaglandinas renales inducen vasodilatación renal y disminución de la reabsorción tubular de sodio en la rama ascendente del Henle, e inhiben también la reabsorción hidrosmótica de la vasopresina en el túbulo colector.
Implicaciones del tratamiento médico de la ICC
1. El tratamiento médico de la ICC con diuréticos y vasodilatadores de acción diurética, puede contribuir a activar aún más los sistemas vasoconstrictores neurohormonales y reducir la concentración del PNA. (11)
2. La aparición de resistencia a los diuréticos y la intolerancia a los vasovodilatadores, en los pacientes con ICC crónica, se deben en parte a la activación de los mecanismos vasoconstrictores inducidos por estos fenómenos. Por ejemplo: la administración de furosemida, un diurético de asa, aumenta la noradrenalina plasmática, la actividad de la renina y la aldosterona, así como el PNA plasmático en pacientes con IC aguda o crónica. (7,12)
Estos efectos neurohormonales del tratamiento diurético pueden contribuir al desarrollo de la resistencia a los diuréticos, porque la mayor actividad nerviosa renal y la angiotensina II aumentan la reabsorción de sodio en el túbulo proximal, enmascarando el efecto beneficioso de un diurético que actúa a nivel del asa de Henle, o de zonas más distales de la nefrona. El tratamiento vasodilatador prolongado con nitroglicerina, determina una rápida tolerancia al fármaco, con retención de líquido que se produce simultáneamente con la activación del sistema renina-angiotensina-aldosterona. Esta tolerancia a los nitritos se evita con la administración simultánea de inhibidores de la enzima convertidora de angiotensina (IECA), lo que parece confirmar la importancia de la activación de los mecanismos vasoconstrictores neurohormonales inducidos por estos fármacos. (12,13)
Los efectos beneficiosos demostrados de los IECA sobre los síntomas, la hemodinámica y la supervivencia de pacientes con IC, apoyan su uso habitual en la ICC, sin embargo, no siempre son capaces de aumentar la excreción renal de sodio.
Estudios recientes sugieren que antagonizar el receptor de la angiotensina II, puede conseguir un efecto más favorable sobre el riñón que la inhibición de la enzima convertidora de angiotensina. Sin embargo, esto tiene que ser confirmado con estudios clínicos más amplios. (12,13)
3. Las dosis bajas o “renales” de dopamina (1-2 µg/kg-1/min-1) pueden mejorar el flujo renal y la TFG, favorecer la natriuresis mediante un efecto directo en el túbulo proximal y facilitar la diuresis en algunos pacientes con ICC avanzada descompensada. Sin embargo, se debe evitar el uso indiscriminado de dopamina en los pacientes con IC, ya que todavía no se han realizado estudios aleatorizados a gran escala de la eficacia clínica.
4. El tratamiento farmacológico de la ICC se suele complicar por la coexistencia de insuficiencia renal crónica (IRC). La utilización de IECA en estos pacientes puede complicar más la situación, debido a las alteraciones de la farmacocinética y el empeoramiento de la disfunción renal, ya que la conservación de la presión glomerular capilar depende particularmente de la constricción de la arteriola eferente inducida por la angiotensina II y el mantenimiento de la presión arterial sistémica. Sin embargo, un ajuste cuidadoso de la dosis permite a muchos pacientes con IC e IRC tolerar los IECA. (14-16)
5. Cuando la TFG desciende por debajo de 30 ml/min, la eficacia de los diuréticos que actúan sobre el túbulo distal (tiazidas y diuréticos ahorradores de potasio) se pierde, por lo que se prefieren en estos casos los diuréticos del asa y la metolazona.
6. La intoxicación con digoxina es frecuente en los pacientes con IRC e IC simultáneamente, ya que la digoxina se elimina fundamentalmente por vía renal. Es necesario ajustar la dosis cuando desciende la TFG. (17)
En un estudio de 6 pacientes con ICC, sensibles a diuréticos, la dopamina no mejoró la sensibilidad a la furosemida, por lo que su uso se debe reservar, posiblemente, para los pacientes con ICC descompensada y cierto gado de resistencia los diuréticos. En este contexto se debe controlar la excreción urinaria antes y durante la infusión de dopamina, para valorar su eficacia clínica, e indicar su administración continuada. (14-16)
La función renal en las hepatopatías
Las hepatopatías suelen acompañarse de una serie de alteraciones en la función renal y en el metabolismo electrolítico, las cuales, aunque en ocasiones no pasan de complicaciones con escasa importancia clínica, pueden llegar a ser graves y a requerir la adopción de medidas terapéuticas. A continuación, se aborda la respuesta de la función renal ante las alteraciones del sodio y del agua en pacientes con síndrome hepatorrenal.
Función renal en alteraciones de sodio
Los pacientes con cirrosis de Läennec presentan una gran tendencia a retener cloruro sódico y suelen excretar una orina prácticamente libre de sodio. Se acumula líquido extracelular en exceso y en ocasiones se manifiesta en forma de ascitis y edema, detectables clínicamente. Si no se impide la ingestión de sodio, la lenta retención de este ión puede determinar una ascitis de grandes proporciones (hasta 20 litros). Cuando se limita la ingesta de sodio, se produce rápidamente el cese de la ganancia de peso y del aumento de la ascitis. (18,19)
La alteración del manejo del sodio en la ascitis no es estática ni inalterable, sino que los pacientes cirróticos pueden presentar una diuresis espontánea, seguida de una nueva retensión de sal. La principal alteración excretora renal, que determina la retención de líquidos, es la alteración en la excreción de sodio, no de agua. Muchos pacientes que retienen sodio, con ascitis y edema, pueden excretar grandes cantidades de orina diluida si se le administran grandes cantidades de agua sin sodio. (18)
La patogenia de la alteración de la homeostasis del sodio en la cirrosis, es sumamente compleja y es objeto de polémicas constantes. Se han planteado tres hipótesis:
1) Hipótesis tradicional: también llamada teoría del “llenado bajo”, implica que la retención renal de sodio es secundaria (no primaria) al trastorno hepático.
Esta hipótesis propone que la formación de la ascitis en los pacientes cirróticos, se inicia con un desequilibrio crítico entre las fuerzas de Starling en los sinusoides hepáticos y los capilares esplácnicos, lo que determina una producción excesiva de linfa que sobrepasa la capacidad del conducto torácico, para hacerla regresar a la circulación. De este modo, se acumula el exceso de líquido en el espacio peritoneal en forma de ascitis.
Simultáneamente, la vasodilatación y la apertura de las comunicaciones arteriovenosas expanden el espacio en el que está contenido el volumen plasmático; se activa la retención de sodio, y la relativa disparidad entre el volumen plasmático y el espacio circulatorio, se percibe como una contracción de volumen plasmático “eficaz”. La retención renal de sodio puede restituir con éxito el volumen plasmático absoluto hasta valores normales, o incluso superiores a los normales, pero, dado el aumento de tamaño del espacio circulatorio en el que se contiene, se manifiesta un estado de contracción de volumen relativo o “eficaz”. El término se refiere a la parte del volumen circulatorio total que resulta eficaz para estimular los receptores de volumen, concepto poco definido ya que no se conocen todos los receptores de volumen. (20,21)
Este fenómeno puede explicar la aparente paradoja que existe por la mantenida retención de sodio en el ámbito renal, incluso en presencia de un volumen plasmático absolutamente aumentado. Se considera que la disminución del volumen eficaz constituye una señal aferente, que desencadena los acontecimientos que culminan en la reabsorción de agua y sal en el túbulo renal.
2) Hipótesis del “sobrereflujo”: la retención renal de sodio y la expansión del volumen plasmático (acontecimiento primario) preceden a la formación de la ascitis. (21)
La hipertensión venosa portal y la reducción de la presión coloidosmótica del plasma, causa alteraciones en las fuerzas de Starling en el lecho venoso portal y en los sinusoides hepáticos. En ese caso, el volumen plasmático expandido se concentra preferentemente en el espacio peritoneal, causando ascitis.
3) Hipótesis de la “vasodilatación arterial periférica”: plantea que lo que básicamente determina el llenado vascular, es la vasodilatación periférica (desequilibrio entre la capacidad aumentada y volumen disponible) que constituye un volumen eficaz disminuido. Se considera una revisión de la teoría del “llenado bajo”. (21)
- Factores eferentes
Los intentos iniciales de explicación de las alteraciones renales responsables de la retención de sodio, se centraron en el descenso de la TFG que se suele observar en los pacientes con hepatopatías avanzadas. Una serie de observaciones indicaban, sin embargo, que el descenso en la TFG no puede ser la principal causa de las alteraciones en el manejo del sodio, ya que dicha retención de sodio se produce en presencia de una TFG normal, o superior a la normal. Por tanto, la retención de sodio renal asociada con la cirrosis se debe principalmente a un aumento de la reabsorción tubular, más que a alteraciones en la carga de sodio filtrada.
No se han determinado aún los mediadores de la reabsorción aumentada, ni su importancia relativa en este proceso. Se han sugerido varios mecanismos como: (21)
1. Hiperaldosteronismo
2. Alteraciones en la distribución intrarrenal del flujo sanguíneo
3. Incremento en la actividad del sistema simpático renal
4. Alteraciones en los eucosanoides, que incluyen la disminución relativa en las prostaglandinas vasodilatadoras renales.
5. Relativa alteración en la generación renal de calicreína
6. Alteraciones en el PNA
7. Modulación de un posible natriurético humoral.
- Tratamiento de la ascitis y el edema (22,23)
1. El tratamiento del paciente cirrótico con ascitis se debe basar en que la ascitis no necesita tratamiento por sí misma, a no ser que sea masiva. El objetivo inicial de cualquier programa de tratamiento debe conseguir la diuresis espontánea, siguiendo un régimen constante y escrupuloso de restricción de sodio (500 mg diarios). Aunque se desconoce con qué frecuencia dicho tratamiento dietético consigue mejorar la ascitis, se debe prescribir a todos los pacientes si se puede, ya que resulta imposible predecir cuáles van a responder satisfactoriamente. Cuando la respuesta a la dieta sea inadecuada, o cuando no sea posible realizar una dieta estricta de restricción de sodio por su coste, o su mal sabor, se deben prescribir fármacos diuréticos.
2. Si no existen razones de urgencia para movilizar el exceso de líquido, el tratamiento debe comenzar con uno de los diuréticos ahorradores de potasio distales. Parece razonable comenzar con dos dosis diarias de espironolactona (100 mg/día). Si no consigue la natriuresis con esta dosis, se puede aumentar de modo escalonado cada 3 a 5 días hasta el máximo de 400 mg diarios. La acción de la espironolactona es lenta y hay que esperar de 3 a 5 días para que el efecto máximo se manifieste.
3. Si con la dosis máxima de la espironalactona no se consigue la natriuresis, se puede añadir un diurético de asa, como la furosemida. Los diuréticos del asa deben llegar a la luz del túbulo renal para ser eficaces a escala farmacológica. Los resultados en pacientes cirróticos muestran mucha variabilidad en la respuesta, aunque en algunos pacientes está claramente reducida la capacidad de conseguir un nivel de fármaco en la orina, suficiente para obtener una respuesta. En dichos pacientes se necesitan dosis dobles o dos veces y medio mayores de los diuréticos del asa, para conseguir una cantidad “normal” en el lugar de acción.
4. Una estrategia terapéutica razonable sería comenzar con dosis convencionales de diuréticos del asa (furosemida 40 mg E/V u 80 mg oral = 1mg de bumetamida oral o E/V). Si la respuesta fuera insuficiente, o no se obtuviera respuesta, habría que aumentar la dosis al menos dos veces y medio. No parece existir justificación para utilizar dosis mayores. Dicha estrategia debe compensar cualquier alteración en la disposición de los diuréticos del asa en los hepatópatas y seguir siendo segura.
5. Actualmente, muchos clínicos tienden a evitar este enfoque y a sustituirlo por paracentesis de grandes volúmenes, debido a la tendencia de reducir la estancia hospitalaria.
Como la paracentesis de grandes volúmenes puede producir hipovolemia, hiponatremia, insuficiencia renal y encefalopatía, su uso en la ascitis refractaria era limitada hasta épocas recientes. Los estudios previos han demostrado una disminución variada en el volumen plasmático después de paracentesis. Además, se ha sugerido que la ascitis en sí misma puede ejercer un efecto negativo sobre la función cardiaca (22-24). Recientemente, varios grupos de investigadores han reevaluado los efectos de la paracentesis de volúmenes grandes (4 a 25 litros diarios hasta que desaparezca la ascitis) o total (movilización completa de la ascitis en una única sesión de paracentesis) y han llegado a la conclusión de que constituye un método de tratamiento eficaz y relativamente seguro para eliminar la ascitis. Al final del procedimiento se empieza a administrar albúmina, u otros expansores de la volemia intravenosos, para evitar los efectos adversos sobre la función renal (22-25). En los casos de ascitis masiva tratada con paracentesis total (>8 litros), se debe administrar la mitad de la dosis de expansores de la volemia, al final del procedimiento y la otra mitad 6 horas después, a fin de prevenir una expansión de volumen rápida, que pueda causar hemorragias en las várices esofágicas o gástricas. (22-25)
En la mayoría de los pacientes, el edema periférico se resuelve con rapidez cuando se elimina la ascitis y suele desaparecer en los dos primeros días de tratamiento. (26)
Función renal en alteraciones del agua
En la cirrosis se suele alterar la capacidad renal de dilución, lo que explica la presencia de hiponatremia, la cual constituye la expresión clínica de esta alteración. La mayoría de los pacientes con cirrosis compensada, excretan agua con normalidad, mientras que en la descompensada se observan respuestas muy variadas ante la carga de agua incorporada por vía oral.
El mecanismo responsable de la alteración del mecanismo de excreción de agua en la cirrosis no se ha establecido por completo, aunque se han propuesto cuatro factores: (23-25)
1. Mayor actividad de la hormona antidiurética (ADH)
2. Reducción de la cantidad de filtrado que alcanza los segmentos diluyente distales de la nefrona.
3. Mayor liberación de prostaglandinas
4. Incremento de la actividad del sistema simpático renal
Tratamiento de la hiponatremia
El trastorno en la dilución de la orina origina importantes problemas en el tratamiento de los pacientes con hepatopatía avanzada (26). La base del tratamiento es la restricción de líquidos, ya que la hiponatremia refleja un estado de dilución, secundario a las alteraciones en la capacidad de excretar el agua. Esta restricción de líquidos consigue en ocasiones recuperar la alteración, sea cual sea su grado. Resulta muy difícil alcanzar este objetivo, aparentemente sencillo; por este motivo, algunas veces se hace necesario mantener un restricción de líquido absoluta, durante los primeros días (0 a 200 ml diarios) para conseguir normalizar el sodio sérico. (22)
Son interesantes los resultados obtenidos con los antagonistas de la vasopresina en fase de desarrollo, que sugieren que podrían resultar de importante ayuda en el tratamiento de la hiponatremia refractaria. (22,23)
Síndrome de azoemia aguda
La insuficiencia renal aguda (IRA) es frecuente en pacientes con patología hepatobiliar. Aunque la azoemia aguda se suele deber a la IRA “clásica”, los pacientes cirróticos desarrollan una forma especial denominada síndrome hepatorrenal (SHR).
Este síndrome se puede definir como la aparición de una insuficiencia renal no explicada en pacientes con hepatopatía, en ausencia de otras evidencias clínicas, de laboratorio o anatómicas, que sugieran otra causa conocida de insuficiencia renal. (27)
- Características clínicas
La presentación clínica y características del SHR se caracterizan por una gran variabilidad. El SHR se suele desarrollar en pacientes con una hepatopatía crónica avanzada e hipertensión portal. Aunque esta forma de insuficiencia renal suele complicar el curso evolutivo de cualquier hepatopatía grave, en la mayoría de los estudios realizados en los Estados Unidos de América, se ha identificado la cirrosis alcohólica como la causa más frecuente. (24-28)
La insuficiencia renal se puede desarrollar en un paciente que días antes haya tenidp una TFG normal y una capacidad de concentración normal. Aunque el SHR puede desarrollarse en un paciente que ha tenido una disminución del volumen sanguíneo eficaz -como después de paracentesis, el tratamiento dietético estricto y hemorragias digestivas-, puede suceder también en ausencia de factores precipitantes. (27)
En general, el SHR suele desarrollarse en pacientes con ascitis, habitualmente a tensión, y otros estigmas de hipertensión portal y hepatopatía crónica, si bien en ocasiones se produce con pocas evidencias de disfunción hepática.
El concepto de que la insuficiencia renal del SHR es funcional, se apoya en un gran número de evidencias que se derivan directamente de:
1. La demostración de que los riñones trasplantados de pacientes con SHR, pueden recuperar la función renal en el receptor del injerto.
2. La recuperación de la función renal normal cuando se trasplanta al paciente con SHR con un “hígado de éxito” (que logra su función adecuada en el paciente receptor).
Los estudios de laboratorio confirman la gravedad de la hepatopatía, ya que muestran prolongación del tiempo de protrombina, reducción de la concentración de albúmina sérica y aumento de la bilirrubina, aunque el grado de ictericia es muy variable. (27)
La mayoría de los pacientes tiene una reducción leve de la tensión arterial sistémica, se reduce el volumen de orina (< 800 ml/día), siendo frecuente la oliguria ( 400 ml/día) y rara la anuria. La creatinina y el nitrógeno ureico en sangre aparecen elevados, pero no suelen alcanzar valores tan altos, lo cual puede infravalorar el grado de alteración de la función renal, ya que los niveles del nitrógeno ureico en sangre suelen estar bajos en los pacientes cirróticos debido a la menor ingesta proteica, secundaria a la anorexia y a la síntesis limitada de urea en el hígado. La creatinina endógena se reduce también por el desgaste muscular en los cirróticos con malnutrición proteica.
La orina suele ser ácida y no es infrecuente la proteinuria leve, la cilindruria y la hematuria microscópica. La orina carece de cloruro sódico (<10 mEq/l) y está poco concentrada (500 a 700 mOsm/kg de agua). En algunas ocasiones, se pueden observar concentraciones de sodio de 20 a 30 mEq/l, lo que puede estar dado por la asociación con necrosis tubular aguda (NTA), o alcalosis metabólica aguda por vómitos.
El pronóstico del SHR es grave. La mayor parte de los pacientes fallecen a las pocas semanas del comienzo de la azoemia, aunque un 5-10% pueden sobrevivir varios meses con azoemia leve. Resulta rara la recuperación de los pacientes con insuficiencia renal avanzada. (27)
- Diagnóstico diferencial
Resulta indispensable distinguir el SHR de las causas prerrenales, sobre todo porque se trata de procesos reversibles si se reconocen y se tratan en las fases iniciales.
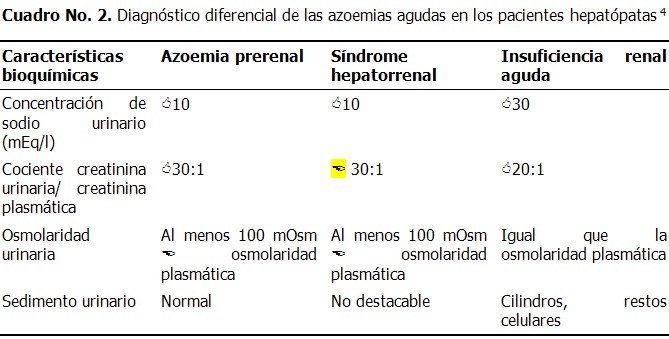
La contracción de volumen, o fracaso de bomba cardiaca, pueden cursar como un síndrome “pseudohepatorrenal”. Existen algunas características de laboratorio, cuyo conocimiento es útil para distinguir las tres causas de azoemia aguda en los pacientes hepatópatas (Cuadro 2). (28)
En resumen, encontrar una concentración de sodio baja en presencia de oliguria, excluye el diagnóstico de NTA. Solo se puede establecer el diagnóstico de SHR cuando se hayan excluido la insuficiencia prerenal y la NTA. (28)
La similitud entre los índices diagnósticos urinarios en la azoemia prerrenal y el SHR, hace que a menudo haya que recurrir a maniobras funcionales, como la administración de expansores de volumen, para distinguir la presencia de una u otra. En este sentido, se debe recordar que el grado de expansión de volemia, necesario para conseguir la repleción del paciente cirrótico, puede ser a veces muy grande, llegando a necesitar la infusión de cantidades masivas de coloides. (28)
- Tratamiento
Dado que actualmente los conocimientos acerca de la patogenia del SHR, derivan de inferencias y son incompletos, el tratamiento debe ser fundamentalmente de sostén. El paso inicial es no equiparar una reducción de la función renal con este síndrome, sino buscar con cuidado las causas corregibles de la azoemia, como la contracción de volumen, la descompensación cardiaca y la obstrucción de las vías urinarias, para proceder a su tartamiento. Se debe realizar el diagnóstico de NTA, ya que los pacientes cirróticos con este diagnóstico se pueden recuperar si se les da tratamiento de sostén con diálisis. Cuando se han excluido las causas corregibles de alteración de la función renal, el tratamiento fundamental es la restricción cuidadosa de sodio y líquidos. Se han ensayado medidas terapéuticas específicas, pero pocas han sido de utilidad práctica. Los ensayos con expansores de volumen de diferentes tipos, solo consiguen una mejoría transitoria de la hemodinámica y la función renal, pero no mejoran de modo significativo el resultado; tampoco los intentos de reinfusión de líquido peritoneal evacuado de la ascitis han conseguido una mejoría duradera. Debido al importante papel asignado a la isquemia renal cortical en la patogenia del SHR, se han utilizado muchos ensayos para tratar el proceso con vasodilatadores. La vasodilatación intrarrenal con vasodilatadores específicos como la acetilcolina, mejora el flujo sanguíneo renal pero no aumenta la TFG; el bloqueo de nervios -adrenérgicos vasoconstrictores, mediante infusión intrarrenal de fentolamina o fenoxibenzamina, tampoco ha producido efectos significativos sobre la TFG. Los resultados obtenidos mediante la infusión de prostaglandinas vasodilatadoras para corregir su posible deficiencia en el riñón, han sido poco alentadores. Se conoce que la diálisis es ineficaz para tratar el SHR; sin embargo, a medida que se acumula experiencia, esta concepción adquiere ciertos matices. La mayor parte de los artículos iniciales que sugerían que los pacientes tenían muy mal pronóstico, basaban sus afirmaciones en estudios de pacientes con una hepatopatía terminal. En algunas ocasiones se han dializado pacientes con SHR, por una enfermedad hepática aguda y se han obtenido resultados. Estas observaciones indican que en pacientes seleccionados, como por ejemplo, aquellos con una disfunción hepática aguda, en los que debe suponerse que la insuficiencia renal mejorará al hacerlo la lesión hepática, está indicada la diálisis.(29)
Recientemente, se ha destacado la importancia de la diálisis como medida de sostén para los pacientes que esperan el trasplante hepático. Como muchos pacientes sometidos a trasplante hepático con o sin IRA, muestran inestabilidad hemodinámica, pueden tolerar mejor el tratamiento con hemofiltración continua. Además, el tratamiento con sustitución renal continua puede ayudar a controlar la encefalopatía hepática y los incrementos asociados en la presión intracraneal.(29)
En cuanto a la utilización de la derivación peritoneo-yugular (derivación de Le Veen) en el tratamiento del SHR, aunque ha sido objeto de gran entusiasmo, se han realizado pocos estudios prospectivos aleatorizados acerca de su empleo, por lo que los datos disponibles no permiten establecer con certeza sus beneficios. (30,31)
Recientemente, se han publicado algunos artículos sobre la mejora en la función renal de los pacientes con, SHR después de la inserción de una derivación porto sistémica intra hepática transyugular. Aunque con esto se evita la necesidad de cirugía vascular mayor, no se trata de un procedimiento tan sencillo ni tan inocuo como plantean algunos de sus defensores, ya que requiere de un operador con gran habilidad y experiencia en radiología intervensionista, para que la inserción sea correcta. Los datos disponibles a favor de su aplicación son muy pocos. (29,32-34)
El trasplante hepático ortotópico se ha convertido en el tratamiento acertado de la hepatopatía terminal. Cabe destacar, que muchos de los pacientes con hepatopatía terminal presentan grados diversos de disfunción renal simultánea, incluido el SHR. Los resultados indican que los pacientes con SHR presentan buena supervivencia después del trasplante hepático, aunque la supervivencia es inferior a los que no tienen un SHR. (29,35,36)
CONCLUSIONES
En la ICC ocurren cambios importantes en la hemodinámica renal debido, a que el FSR va decreciendo por aumento de la resistencia vascular renal, lo que trae como consecuencia una disminución de la TFG y aumento de la actividad adrenérgica renal, expresada en un incremento de la angiotensina II, la cual provoca activación neurohormonal vasoconstrictiva en la ICC; esto se perpetúa al fallar los mecanismos renales de vasodilatación hormonal, ya que la respuesta renal a los péptidos natriuréticos disminuye a medida que la insuficiencia cardiaca empeora. Todo esto repercute en el tratamiento farmacológico del paciente con ICC.
El SHR constituye una forma especial del síndrome de azoemia renal aguado, por su carácter funcional. Se presenta en pacientes con hepatopatía que desarrollen una IRA en ausencia de otras causas de fallo renal agudo. El tratamiento de este síndrome debe ser fundamentalmente de sostén (restricción cuidadosa de líquido y sodio), dirigido sobre todo a buscar causas corregibles de azoemia renal (constricción de volumen, descompensación cardiovascular, obstrucción urinaria, nefrotoxicidad) para proceder a su tratamiento. La diálisis es importante como medida de sostén para los pacientes que esperan trasplante hepático, la hemofiltración continua es la técnica mejor tolerada.