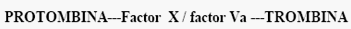INTRODUCCIÓN
Los fármacos anticoagulantes orales derivados de la Cumarina (y en algunos casos derivados de las indandionas) son de uso común en el tratamiento y la profilaxis de los trastornos trombóticos. Los fármacos cumarínicos inhiben la biosíntesis hepática de los factores de la coagulación dependientes de vitamina K y es preciso ajustar periódicamente la dosis para cada paciente con objeto de garantizar un grado de coagulación suficiente pero no excesivo. Los ajustes se basan en el tiempo de protrombina o en una prueba similar realizada en la sangre del paciente.1,2 Cuando a un plasma citratado se le agrega un exceso de tromboplastina hística y se recalcifica, el tiempo que demore en formarse el coágulo se puede tomar como índice de los factores que intervienen en la fase extrínseca de la coagulación (factor II, V, VII, IX). Este constituye el fundamento del tiempo de protrombina. el cual se encuentra prolongado en diferentes estados tales como: déficit congénito de los factores II, V, VII, Y X; tratamiento con anticoagulantes dicumarínicos; daño hepático severo; en recién nacidos y prematuros; en la coagulación intra vascular diseminada.2-4
De hecho esta prueba exige el uso del reactivo denominado tromboplastina, la cual se controla mediante el uso de tromboplastinas calibradas y plasma.5,6
El término tromboplastina fue empleado por autores antiguos para designar la acción de extractos hísticos para acelerar la coagulación. Cuando es preparada con tejidos de mamíferos contiene proteínas y fosfolípidos. La que sólo contiene un extracto tisular recibe el nombre de simple, mientras que la que tiene otros componentes como fibrinógeno, factor V o calcio, se denomina combinada. También se pueden clasificar las tromboplastinas por tipos según el origen del tejido animal de que procedan (humano, bovino, de cerebro, de pulmón, de conejo o de placenta humana), teniendo en cuenta que sólo deben ser a partir de animales sanos.
Es importante tomar todas las precauciones para utilizar un material de partida lo menos contaminado posible y un procedimiento de fabricación que impida nuevas contaminaciones y la proliferación de microorganismos durante el mismo.7
Se ha planteado que la conversión de protrombina en trombina es mediada por la acción enzimática de un complejo enzimático (Factor X/Factor Va) que se encuentra en la superficie de la membrana celular, el cual necesita de la presencia de los iones de calcio y tiene como sustrato la protrombina. El factor V circula como un cofactor inactivo. Este complejo tiene un PM =38 000188-191.
El suministro del reactivo comercial por la empresa productora EPB Carlos J. Finlay se ha visto severamente afectado y la adquisición del órgano (cerebro humano) necesario para su producción de forma habitual en nuestro medio es sumamente difícil ya que debe reunir determinadas características que son imprescindibles para ello, además de ser menos ético, por lo que es necesario buscar vías alternativas que ayuden a resolver esta dificultad, a través de la extracción salina de tromboplastina de placenta y la estandarización del tiempo de protombina con este nuevo reactivo.
MATERIALES Y MÉTODOS
Se utilizó placenta humana obtenida del Servicio de Ginecoobstetricia del Hospital General Universitario Dr. “Gustavo Aldereguía Lima”, seleccionada por el obstetra que asistió el parto, según criterios previamente acordados, sobre la base del análisis de estudio sobre placenta,8,9 con el fin de utilizar aquellas que pertenecieran a mujeres con embarazos y partos normales y con marcadores seroepidemiológicos negativos ( VIH, HbsAg, VHC, VDRL ).
Criterios que se tuvieron en cuenta para la selección de la placenta.: edad materna entre 20 y 30 años; pruebas durante el embarazo de VIH, antígeno de superficie, VHC, serología VDRL, con resultados negativos; no alteraciones durante el embarazo de: diabetes, toxemia, sepsis urinaria, otras; edad gestacional al parto entre 37 y 40 semanas; peso del recién nacido, entre 2500 g y 3000 g.
Se recogió además el nombre de la madre y el número de la historia clínica Inmediatamente después del alumbramiento se colocaron en un recipiente con suficiente solución salina al 0.9 % para cubrir todo el tejido placentario y se trasladará al laboratorio para proceder a la limpieza y preparación de la misma.
Material y cristalería necesarios: Cubeta, pinza, tijera, 2 beaker de 200 ml, guantes, papel de filtro, mortero.
Equipamiento: Homogeneizador de cuchillas o en su defecto batidora eléctrica, freezer de 20 0C, centrífuga de tubo, balanza analítica.
Reactivos: Solución salina (8 frascos 500cc), buffer veronal, H20 destilada.
Obtención de la materia prima.
Se tomó la placenta y se lavó con suficiente solución salina al 0,9 % para eliminar la sangre hasta que quedó bien lavada y se pudieron eliminar con facilidad todas las membranas. Seguidamente se tomaron pequeños fragmentos de tejidos de la zona central y periférica para lograr una mayor representabilidad de este órgano. Estos tejidos fueron introducidos en un beaker que contenía solución salina al 0,9 %, la cual fue cambiada cada 1 hora y mantenida a 4 0C. Posteriormente se dejó en esta solución aproximadamente 24 horas a 4 0C. Transcurrido este tiempo se eliminó la solución salina y se lavó abundantemente con la misma, hasta quedar libre de sangre, se secó bien con papel de filtro, quedando listo para ser pesado y homogeneizado.
Preparación del homogeneizado.
El tejido placentario fue pesado y por cada 100g de este se añadieron 150 ml de buffer salino (7 partes de solución salina y 3 partes de Buffer Veronal) preincubado a 370C, se procedió a su homogeneización en una batidora eléctrica durante 10 minutos. Posteriormente, utilizando un mortero, se maceraron las partículas en suspensión que quedaron después del proceso anterior. Esta mezcla se centrífugo a 3000 rpm en una centrífuga marca Electronic durante 10 min. El sobrenadante fue decantado y distribuido en alícuotas. que se mantuvieron refrigeradas a 20 0C.
Desarrollo de la técnica analítica.
Obtenida la tromboplastina se procedió a realizar la técnica del tiempo de protrombina en el departamento de coagulación del laboratorio clínico empleando la forma habitual.3
Estandarización del ensayo con tromboplastina placentaria.
En general la calibración y/o estandarización de una tromboplastina es más precisa cuando se hacen comparaciones entre preparaciones análogas de la misma especie,6 por ello basamos nuestro estudio en comparar los resultados del tiempo de protrombina utilizando extracto de tejido cerebral humano con el extracto salino de placenta, obtenido en el estudio. El extracto cerebral fue donado por el Hospital Clínico Quirúrgico “Hermanos Ameijeiras. Las determinaciones fueron realizadas por un solo analista perteneciente a la sección de coagulación del Laboratorio Clínico. Para ello se seleccionaron aleatoriamente 145 pacientes que acudieron a la consulta del Laboratorio Clínico para realizarse este ensayo y/u otros, 91 de ellos eran pacientes sin tratamiento anticoagulante y 54 sometidos a tratamiento anticoagulante. Para el tratamiento estadístico nos apoyamos en el paquete estadístico SPSS (versión 9.0 castellano) aplicando la prueba T para muestras dependientes.
RESULTADOS
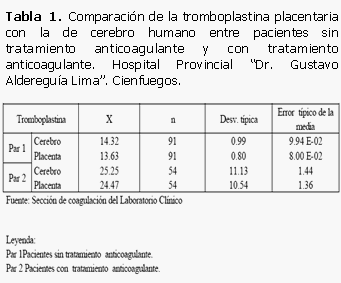
La tromboplastina humana obtenida tuvo un control de 13 seg. Al compararla con la de cerebro humano en ambos grupos observamos lo siguiente: Entre los pacientes del grupo 1 (sin tratamiento con anticoagulante) y grupo 2 (bajo tratamiento con anticoagulantes) existió poca diferencia en la media, presentaron su respectiva desviación típica y el error típico de la media. Comprobamos una menor desviación y error típico con la tromboplastina de placenta en ambos grupos en relación con la de cerebro.
Al comparar la correlación entre ambos métodos (tromboplastina de cerebro y tromboplastina de placenta) en cada uno de los grupos de estudio se comprobó que existe una correlación lineal, fuerte y directa entres ambos métodos, pues están por encima de 0,65. (0,65 <X<0,85). (Tabla 1)
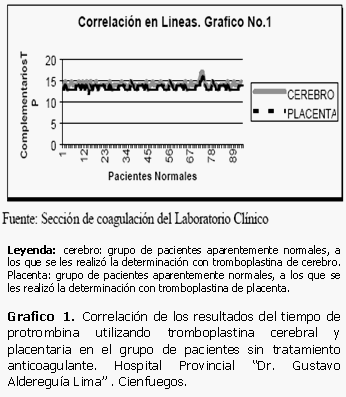
La correlación existente entre los datos obtenidos al muestrear los pacientes aparentemente normales muestra que existe una similitud de los valores que se encuentran inmersos en un rango muy estrecho, casi superpuesto, existiendo muy poca diferencia entre ellos. (Tabla 2)
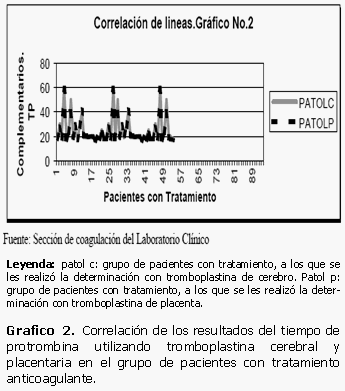
De forma similar ocurre en el caso de las muestras correspondientes a 54 pacientes con tratamiento anticoagulante. Los datos pertenecientes a las determinaciones del tiempo de protrombina realizadas con tromboplastina de cerebro y de placenta se encuentran casi en el mismo rango, no existen prácticamente variaciones entre las variables utilizadas llegando a ser todavía mucho más positiva y directa la correlación existente entre ellas si la comparamos con el par 1 constituido por los datos en pacientes aparentemente normales. (Gráficos 1 y 2)
Al calcular el costo de producción y la ejecución analítica de nuestro producto y compararla con la tromboplastina comercial producida por la EPB “Carlos J. Finlay”, apreciamos un ahorro de nueve centavos por cada determinación, si tenemos en cuenta que como promedio se realizan 700 determinaciones mensuales en el laboratorio clínico del hospital, esto representa un ahorro de sesenta y tres pesos al mes.
DISCUSIÓN
La tromboplastina obtenida de placenta humana mediante la extracción salina resultó útil para la realización del tiempo de protrombina, ya que los resultados obtenidos en ambos grupos de pacientes (sin tratamiento y con tratamiento) fueron comparables con la del reactivo estandarizado (tromboplastina de cerebro). Existió perfecta correlación entre ambos resultados por lo que podemos afirmar que no existe diferencia significativa en los resultados del ensayo utilizando la tromboplastina de placenta humana.
Adicionalmente se comprobaron algunas ventajas con la utilización de placenta para obtener tromboplastina. Una es la mayor accesibilidad al tejido, ya que para utilizar un cerebro humano, este debe provenir del cadáver de una persona joven, con menos de 24 horas de fallecida, sin ninguna enfermedad del sistema nervioso central, así como traumas u otras situaciones y el tejido no puede presentar signos de congestión o evidencias de pus o tumor. Mientras que la placenta se puede obtener de los disímiles partos que a diario se producen en las maternidades y es mucho más sencilla y fácil su manipulación y conservación. Otra ventaja es que la producción de esta tromboplastina es mucho menos costosa, si la comparamos con la tromboplastina de producción nacional de la EPB “Carlos J. Finlay”.
Teniendo en cuenta los resultados de este trabajo podemos llegar a la conclusión que reactivo tromboplastina, utilizado para la determinación del tiempo de protrombina, puede ser obtenido de la placenta humana mediante extracción salina. Por otro lado, el control del tiempo de protrombina realizado con tromboplastina de la placenta humana es de 13 seg., resultado que es similar al encontrado cuando se utiliza productos del cerebro humano. Por último, El proceso de obtención de tromboplastina placentaria resulta poco costoso y de fácil adquisición.